자연과학 및 공학 연구개발업 - 지아이이노베이션 -

지아이이노베이션은 2017년 7월 19일 설립되어, 융합단백질을 이용한 신약 연구개발 및 제품화 판매업 그리고 신기술의 사용권 대여 및 양도 등을 주요사업으로 영위하고 있습니다.
| 목적사업 |
| 1. 의약품, 수의약품, 의약외품의 개발 및 제조, 도소매, 무역업 2. 건강기능식품의 개발 및 제조, 도소매, 무역업 3. 화장품 개발 및 제조, 도소매, 무역업 4. 개발한 신기술의 사용권 대여 및 양도업 5. 수입의약품, 수입건강기능식품, 수입화장품의 판매업 및 위탁업 6. 동물용 의약품 및 기능성 사료 등의 개발 및 제조, 도소매, 무역업 7. 지적재산권 관리업 8. 기술 연구 및 연구 용역업 9. 시장조사, 경영자문, 컨설팅업, 위탁업무 지원 사업 10. 부동산 매매 및 임대업 11. 각 호에 연관되는 일체의 부대사업, 투자, 수출입업 |
주요 연혁
| 년월 | 내용 |
| 2017.07 | ㈜지아이이노베이션 설립 |
| 2017.09 | GI-301 기술 및 GI-210 기반기술 도입(㈜프로젠) |
| 2017.11 | 한국벤처캐피탈협회 벤처기업인증 |
| 2018.05 | 기업부설연구소 인가 |
| 2018.05 | 주식액면분할 1,000원 → 500원 |
| 2018.06 | ㈜삼성바이오로직스와 전략적 개발 파트너쉽 체결 |
| 2018.06 | ㈜메디오젠과 MOU 체결 |
| 2018.09 | 대한민국 바이오 의약품 대상 '글로벌 챌린저상' 수상 |
| 2018.09 | 관계회사 지아이바이옴 설립 |
| 2018.10 | BINEX와 전략적 개발 파트너십 체결 |
| 2018.10 | 228억원 시리즈A 투자 유치 |
| 2018.10 | 관계회사 지아이셀 설립 |
| 2019.04 | 지아이바이옴, 지아이셀과 MOU 체결 |
| 2019.05 | ㈜삼성바이오로직스 CDMO 계약 체결 |
| 2019.06 | 보건복지부 주관 '2019 연구자 주도 질병 극복 면역 중개 연구' 선정 |
| 2019.06 | 유럽 알레르기 임상면역학회(EAACI) 구두발표 |
| 2019.08 | 유한양행과 MOU 체결 및 375억원 시리즈B 투자 유치 |
| 2019.10 | GI-301 및 GI-311 특허권 양수(㈜프로젠) |
| 2019.11 | 중국 심시어 사 7억9천만달러 규모 면역항암제 GI-101 기술 수출(중국 지역 한정) |
| 2020.01 | 관계회사 메디오젠 주식 취득 |
| 2020.03 | 309억원 시리즈C 투자 유치 및 디엠바이오와 CDMO 계약 체결 |
| 2020.04 | 국제백신연구소와 코로나19 백신 면역증강제 공동개발 MOU 체결 |
| 2020.04 | 병역특례 지정업체 선정 |
| 2020.06 | ㈜와이바이오로직스와 면역항암제 후보물질 이전 계약 체결 |
| 2020.07 | 유한양행 1.4조원 규모 알레르기 치료제 GI-301 기술 이전(일본 제외 전세계 지역) |
| 2020.07 | 글로벌 제약사 MSD와 면역항암제 GI-101 키트루다 공동임상 협약 |
| 2020.10 | 애질런트와 바이오마커 프로파일링 연구 협력 위한 MOU 체결 |
| 2020.10 | GI-101 과학기술정보통신부 '2020 국가연구개발 우수성과 100선' 선정 |
| 2020.12 | GI-301 대만특허 등록 |
| 2021.01 | GI-101 한국특허 등록 |
| 2021.01 | 루닛과 차세대 혁신신약개발 위한 공동연구 MOU 체결 |
| 2021.04 | GI-101 한국 임상 1/2상 IND 승인 |
| 2021.04 | ISO27001 인증 |
| 2021.06 | 448억원 SI 투자자, 1,155억원 FI 투자자 Pre-IPO 투자 유치 |
| 2021.06 | GI-101 미국FDA 임상 1/2상 IND 승인 |
| 2021.07 | GI-301 한국 임상 1상 IND 승인 |
| 2021.09 | GI-311 대만특허 등록 |
| 2021.10 | 임상개발전문기업 메디라마와 신규 면역항암제 개발 협력 MOU 체결 |
| 2021.10 | GI-104 한국 특허 등록 |
| 2021.11 | 유니콘 특례 상장 위한 기술평가 통과 |
| 2021.11 | 독일 머크와 바이오 신약 개발 위한 MOU 체결 |
| 2021.11 | GI-301 남아프리카공화국 특허 등록 |
| 2021.12 | 아스트라제네카와 면역항암제 GI-101 임핀지® 병용 연구를 위한 임상 협력 체결 |
| 2021.12 | 지식재산 경영인증 |
| 2021.12 | GI-311 이스라엘, 남아프리카공화국 특허 등록 |
| 2022.01 | 대한민국 우수특허 대상 |
| 2022.01 | GI-101 대만 특허 등록 |
| 2022.01 | GI-210B1 한국 특허 등록 |
| 2022.02 | 셀키와 차세대 혁신 면역항암제 개발을 위한 바이오마커 공동연구 MOU 체결 |
| 2022.03 | 지아이이노베이션·지아이셀·연세의료원, 첨단바이오의약품 생산 위한 세포치료센터 설립 MOU 체결 |
| 2022.04 | 코스닥 상장 예비심사청구서 제출 |
| 2022.05 | 국가신약개발사업단 최대70억원 규모 신약임상개발과제 선정 |
| 2022.06 | GI-101 美 물질 특허 등록 |
최대주주 및 그 특수관계인의 주식소유 현황
| (기준일 : 2022.06.30) | (단위 : 주, %) |
| 성명 | 관계 | 주식의 종류 |
소유주식수 및 지분율 | 비고 | |||
| 기초 | 기말 | ||||||
| 주식수 | 지분율 | 주식수 | 지분율 | ||||
| 장명호 | 본인 | 보통주 | 1,499,403 | 7.51 | 1,499,403 | 7.50 | - |
| 남수연 | 등기임원 | 보통주 | 580,631 | 2.91 | 617,561 | 3.09 | 주식매수선택권 행사, 구주양수 |
| 서주영 | 관계사임원 | 보통주 | 105,745 | 0.53 | 105,745 | 0.53 | 2022년 4월 13일 퇴사 |
| 김진만 | 미등기임원 | 보통주 | 81,505 | 0.41 | 83,005 | 0.41 | 주식매수선택권 행사 |
| 오영민 | 미등기임원 | 보통주 | 75,729 | 0.38 | 75,729 | 0.38 | - |
| 양윤석 | 최대주주의 친인척 | 보통주 | 69,648 | 0.35 | 69,648 | 0.35 | - |
| 서기호 | 관계사임원 | 보통주 | 38,250 | 0.19 | 33,750 | 0.17 | 구주양도 |
| 양경림 | 최대주주의 친인척 | 보통주 | 20,493 | 0.10 | 20,493 | 0.10 | - |
| 이한성 | 관계사임원 | 보통주 | 21,427 | 0.11 | 21,427 | 0.11 | - |
| 김봉모 | 최대주주의 친인척 | 보통주 | 15,908 | 0.08 | 15,908 | 0.08 | - |
| 김진호 | 관계사임원 | 보통주 | 13,285 | 0.07 | 13,285 | 0.07 | - |
| 이경화 | 미등기임원 | 보통주 | 7,142 | 0.04 | 8,642 | 0.04 | 주식매수선택권 행사 |
| 홍천표 | 관계사임원 | 보통주 | 10,713 | 0.05 | 10,713 | 0.05 | - |
| 장홍국 | 미등기임원 | 보통주 | 2,630 | 0.01 | 2,630 | 0.01 | - |
| 박재찬 | 관계사임원 | 보통주 | 2,500 | 0.01 | 2,500 | 0.01 | - |
| 윤나리 | 미등기임원 | 보통주 | 9,386 | 0.05 | 17,586 | 0.09 | 주식매수선택권 행사 |
| 지형남 | 최대주주의 친인척(직원) | 보통주 | 6,700 | 0.03 | 3,700 | 0.02 | 증여 |
| 김도연 | 최대주주의 친인척 (관계사직원) |
보통주 | 3,000 | 0.02 | 3,000 | 0.02 | - |
| 강창훈 | 최대주주의 친인척 | 보통주 | 1,000 | 0.01 | 1,000 | 0.01 | - |
| 이원석 | 관계사임원 | 보통주 | 350 | 0.00 | 350 | 0.00 | - |
| 안인복 | 관계사임원 | 보통주 | 800 | 0.00 | 800 | 0.00 | - |
| 하단비 | 미등기임원 | 보통주 | 350 | 0.00 | 350 | 0.00 | - |
| 조영규 | 미등기임원 | 보통주 | 800 | 0.00 | 2,800 | 0.01 | 주식매수선택권 행사 |
| 오정현 | 미등기임원 | 보통주 | 9,000 | 0.05 | 12,086 | 0.06 | 주식매수선택권 행사 |
| 권순탁 | 미등기임원 | 보통주 | 843 | 0.00 | 2,952 | 0.01 | 주식매수선택권 행사, 2022년 5월 23일 퇴사 |
| 주식회사 지아이이노베이션 |
자기주식 | 보통주 | 0 | 0.00 | 3,000 | 0.01 | 증여 |
| 계 | 보통주 | 2,577,238 | 12.90 | 2,628,063 | 13.13 | - | |
| 우선주 | 0 | 0.00 | 0 | 0.00 | - | ||
◆ 5% 이상 주주 및 우리사주조합 등의 주식 소유현황
| (기준일 : 2022년 6월 30일) | (단위 : 주, %) |
| 구분 | 주주명 | 주식의 종류 | 소유주식수 | 지분율 | 비고 |
| 5% 이상 주주 | 장명호 | 보통주 | 1,499,403 | 7.50 | - |
| 우리사주조합 | - | - | - | - | |
◆ 소액주주 현황
| (기준일 : 2022년 6월 30일) | (단위 : 명, 주, %) |
| 구 분 | 주주 | 소유주식 | 비 고 | ||||
| 소액 주주수 |
전체 주주수 |
비율 (%) |
소액 주식수 |
총발행 주식수 |
비율 (%) |
||
| 소액주주 | 1,223 | 1,249 | 97.92 | 6,791,089 | 20,004,200 | 33.95 | - |
주요 사업
지아이이노베이션은 탄탄한 중개연구를 통해 혁신 단백질 신약을 연구개발하는 바이오벤처 기업입니다. 지아이이노베이션의 주요 연구개발 분야는 면역항암제와 알레르기 치료제이며, GI-SMART™ 플랫폼을 이용해 이중융합단백질을 개발하고 있습니다. 현재는 기존에 개발 중인 면역항암제와 알레르기 치료제와 함께 비알콜성지방간염(NASH) 치료제 등 후속 파이프라인에 대한 연구개발을 진행 중에 있습니다.
지아이이노베이션의 주요 목표 시장은 다음과 같습니다.
◆의약품
의약품이란 질병의 치료 및 증상 완화에 쓰이는 특정한 물질로서, 의약외품과 의료기기가 아닌 물질로 정의됩니다. 또한, 대한민국의 약사법에서 의약품은 처방 유무에 따라 일반의약품과 전문의약품으로 나뉘고 있으며, 이 중 지아이이노베이션은 전문의약품을 개발하는 회사입니다.
전문의약품 중 지아이이노베이션이 주력으로 개발하고 있는 분야는 난치성 암을 치료하기 위한 항암제, 알레르기 질환 치료제를 비롯한 다양한 면역 치료제이며, 두 개의 유효성분을 독자적 노하우로 결합한 단백질 의약품 및 항체 치료제 형태로 개발하고 있습니다.
시장조사기관인 이밸류에이트파마 사의 전세계 의약품 시장 현황 및 전망 (World Preview 2020, Outlook to 2026)에 따르면, 전문의약품(prescription drug) 시장 규모는 2020년 기준 매출액이 9,050억 달러로 2026년까지 연평균 7.4%의 고성장이 예측되며, 매출액은 1조 3,910억 달러에 이를 것으로 예상되고 있습니다.

◆항암제
신체를 구성하고 있는 가장 작은 단위인 세포(cell)는 끊임없이 분열하고, 성장하며 죽어 사라지는 과정을 거칩니다. 정상적인 세포는 세포 내 조절 기능에 의해 이 과정을 통제하여 세포수의 균형을 유지합니다. 즉, 어떠한 원인으로 세포가 손상을 받는 경우, 회복 과정을 통해 정상적인 세포로서의 역할을 하게 되거나 회복이 안 된 경우 스스로 죽게 됩니다.
여러가지 이유로 인해 이러한 일련의 과정이 조절되지 않는 경우가 발생 시, 비정상적인 세포들이 통제되지 못하고 과다하게 증식하게 됩니다. 이로 인해 생성된 종괴는 주위 조직과 장기에 압박을 가하고 혈관을 통한 영양분과 산소의 흐름을 차단하여 정상 조직의 파괴를 초래하게 되는데, 이러한 상태를 암(cancer)이라 정의할 수 있습니다. 항암제는 이러한 암을 치료하는 목적으로 개발된 의약품으로, 주로 난치성 암 치료를 위한 의약품을 개발하고 있습니다.
현재 암의 표준 치료법은 크게 △ 수술을 통한 암의 절제 △ 암 크기 축소 또는 재발 방지를 목적으로 하는 방사선 치료, 그리고 △ 약물로 암의 성장을 막거나, 암세포를 제거하는 항암제 치료의 3 가지로 나뉩니다.
항암제는 다시 △ 1세대 화학항암제 △ 2세대 표적항암제 △ 3세대 면역항암제가 있으며, 다양한 항암제들을 단독 또는 같이(병용 요법) 사용합니다.
1세대 항암제인 화학항암제는 세포의 분열과 성장을 막는 독성 물질을 이용하여 암세포를 직접 공격하는 방식으로, 폐암, 위암 등의 초기에 사용되는 '파클리탁셀 (Paclitaxel)' 등이 대표적 약물입니다. 그러나 화학항암제는 분열이 빠른 장 세포, 모근 세포 등 정상세포까지 공격을 받아 구토, 탈모 등의 심각한 부작용을 유발하는 단점이 존재합니다.
이 같은 화학항암제의 부작용을 줄이기 위해 암세포가 발현하는 특정 단백질이나 유전자 변화를 인식하여 암세포를 선택적으로 공격하는 표적치료제가 2세대 항암제로 개발되었습니다. 암세포에서 활성화되는 신호전달을 억제하는 티로신키나제억제제 (Tyrosine kinase inhibitor; TKI)인 '글리벡(Gleevec®)', 유방암 등에서 많이 발현하는 Her2 단백질을 차단하는 '허셉틴(Herceptin®)', 암에 영양분과 산소를 공급하는 새로운 혈관의 생성을 막는 혈관내피세포 성장인자 저해제 (Vascular endothelial growth factor; VEGFi)인 '아바스틴(Avastin®)'이 대표적인 약물입니다. 그러나 표적치료제는 특정 유전자 변화가 있는 환자들에서 제한적으로 사용이 가능하고, 치료제에 대한 내성이 잘 생긴다는 한계가 있습니다.
암은 전 세계적으로 높은 발병률과 사망률을 보이고 있으며, 암을 정복하기 위한 인간의 노력은 끊임없이 지속되어 왔습니다. 국립암정보센터의 통계자료에 따르면 2018년 국내 암 발생자 수는 총 243,837명이며, 우리나라 국민들이 기대수명(83세)까지 생존할 경우 암에 걸릴 확률은 남자는 5명 중 2명(39.8%), 여자(86세)는 3명 중 1명(34.2%)으로 추정되었습니다. 또한 미국의 경우에도 남자 5명 중 2명(40.1%), 여자 8명 중 3명(38.7%)에서 암이 발생할 것으로 예측되고 있습니다 (출처: 국가암정보센터, 2020; Siegel, R. et al. CA: A Cancer Journal For Clinicians (2020) 70(1):7-30).이러한 결과로 항암제는 주요 질병 치료제 중 가장 큰 시장점유율을 가지고 있으며, 암환자의 증가와 더불어 면역항암제를 포함한 다양한 항암제 시장의 성장에 힘입어 2019년 기준 1,454억달러에서 2026년 3,112억달러로 규모로 연평균 11.9%의 높은 성장세를 나타낼 것으로 전망되고 있습니다 (출처: World Preview 2020, Outlook to 2026, EvaluatePharma 2020). 또한 항암제 시장은 암환자의 생존율을 높이고 삶의 질을 개선시키기 위한 미충족 의료 수요(unmet medical needs)가 여전히 높은 분야입니다.

◆면역항암제
2000년대 초부터 암 치료에 대한 여러 방법과 치료제가 개발되었습니다. 그러나 많은 부작용과 제한된 치료 효과로 인해 대안에 대한 수요가 지속되어 왔으며, 다양한 방법을 찾는 끊임없는 연구가 수행되었습니다. 최근에는 우리 몸의 면역체계를 이용한 면역항암제가 기존 항암제의 대안으로 급부상하였으며, 이러한 면역항암제를 개발하고 있습니다.
항암제의 문제를 극복하기 위해 2010년대 들어 본격적으로 환자의 면역체계를 활성하여 암세포를 제거하는 방식인 3세대 항암제, 면역항암제가 주목받기 시작했습니다. 면역항암제는 인체의 면역세포가 암 세포를 제거하도록 유도하며, 이 과정에서 후천적인 학습이 가능한 면역계의 특성 (후천면역 또는 획득면역)을 이용합니다. 즉, 암세포를 한번 인식한 면역세포는 특이적(specificity)으로 그 인식 과정을 기억(memory)할 수 있어, 장기적인 치료 효능과 함께 다른 조직으로 이동(전이)된 암에 대한 억제 효능도 함께 기대할 수 있게 되었습니다. 또한 우리 몸의 면역체계를 이용하므로 독성 물질을 이용하는 기존 치료제와 비교하여, 낮은 부작용을 특징으로 나타내므로 기존 항암치료제의 패러다임을 바꾸는 혁신적인 치료제로서 각광받고 있습니다.
2010년 이후 면역항암제 시대를 연 대표적인 면역항암제는 면역세포에 발현하여 세포의 기능을 낮추는 면역관문분자(Immune checkpoint molecules)인 CTLA-4, PD-1, PD-L1 등과 결합하는 항체의약품입니다. 이들 항체의약품을 면역관문억제제(Immune checkpoint inhibitors; ICIs)라 하며, 2011년 브리스톨마이어스스큅(BMS) 사가 출시한 '이필리무맙(제품명: 여보이®)'이라고 하는 CTLA-4에 대한 항체을 비롯하여, 면역관문분자 PD-1에 대한 항체인 니볼루맙(제품명: 옵디보®)과 펨브로리주맙(제품명: 키트루다®), PD-L1에 대한 항체인 아테졸리주맙(제품명: 티센트릭®)과 더발루맙(제품명: 임핀지®) 등이 있습니다. 현재 여러 글로벌 제약 회사와 바이오텍 기업들이 앞다투어 면역관문억제제 기반의 항체와 이중항체를 포함한 새로운 면역항암제 개발을 진행하고 있으며, 2021년 의약품 매출 규모 상위 10대 의약품 안에 항 PD-1 항체인 옵디보®과 키트루다®가 위치하여, 면역항암제는 항암제 시장의 실질적인 대세로 자리 매김하고 있습니다.
한편, 면역관문억제제가 본격적으로 개발되기 이전에도 우리 몸의 면역세포들이 생산해 분비하는 단백질인 사이타마인(cytokine)을 활용한 치료요법이 면역항암치료요법 중 하나로 시도되어 왔습니다. 특히, 사이토카인의 한 종류인 인터류킨(interleukin, IL)은 20여 종의 인터류킨에 대한 항암효과가 활발히 연구되고 있습니다. 그 중 항암 효과가 가장 명확히 증명된 것은 인터류킨-2(interleukin-2, IL-2)으로, 인간의 IL-2 단백질을 만들어 투여하는 형태의 알데스류킨(제품명: 프로류킨®)은 1992년 최초로 FDA 승인을 받은 이래 현재까지 흑색종과 신장세포암 치료제로 처방되고 있습니다. IL-2는 암세포를 제거하는 면역세포들의 증식과 분화를 촉진하고, 세포 살해능을 증가시켜 암에 대한 우리 몸의 면역반응을 증진시킬 수 있음이 증명되었습니다.
병용투여 요법은 각기 다른 항암효과를 가진 치료 타깃에 대한 치료제들의 효능을 극대화할 수 있어 항암 효능의 상승효과(Synergic effect)를 기대할 수 있습니다. 이에 최근의 면역항암제 연구개발 트렌드의 초점은 어떤 환자가 면역관문억제제에 반응하는지, 반응하는 환자 수를 어떻게 끌어 올릴 수 있는지에 집중되고 있으며, 특히 반응하는 환자 수를 끌어올리기 위해 다양한 방식으로 병용요법이 진행 중입니다. 기존의 치료 방법 중 화학항암제를 활용하는 방식에서부터 표적항암제 혹은 다른 면역관문억제제, 그 외 다양한 치료제와의 최적의 조합 연구가 활발히 진행되고 있습니다. 이 중에서도 PD-1에 대한 항체인 키트루다® 및 옵디보®를 중심으로 병용 요법에 대한 임상이 가장 활발하게 진행 중이며, 이들 항 PD-1 항체의 단독 투여로 부족한 항암 효과에 대해 자체 개발한 항체와 병용할 수 있는 적합한 파트너를 물색하는 방향으로 진행되고 있습니다. PD-1/PD-L1을 타깃으로 하는 면역관문억제제의 경우 총 4,400건의 단독 또는 병용 임상시험(2020년 9월)이 진행되고 있고, 이 중 병용임상시험은 총 3,498건에 이릅니다. 키트루다®의 임상시험의 경우 단일요법이 2017년과 2020년에 각각 160건과 262건인 반면, 병용요법은 2017년과 2020년에 각각 397건과 937건으로 단일요법 대비 각 2.5배와 3.6배로 크게 증가했습니다.

지금까지는 보다 명확한 타겟을 발굴하여 이를 대규모 임상을 통해 입증하고 그 결과를 토대로 허가를 만들어냈던 단독요법 중심이었으나 이제는 초기 면역항암제 개발 열기를 지나 병용요법의 개발이 본격적으로 항암 치료의 제2 라운드에 돌입했다고 할 수 있습니다.
폭발적으로 성장하는 항암제 시장의 주요 배경으로는 차세대 항암제인 면역항암제의등장을 꼽을 수 있습니다. 앞서 언급한 것과 같이 면역항암제는 우리 몸의 면역체계를 활성화시켜 암을 제거하는 암 치료법으로, 환자의 몸 속 면역체계를 활용하기 때문에 부작용이 비교적 적은 것으로 알려져 있습니다. 또한 환자의 면역 기능을 복원시켜 암을 이겨내는 형태로, 각각의 암에 적합한 타깃을 찾아내 직접적으로 공격하는 기존의 표적치료제와 비교하여 다양한 암에 적용이 가능하므로 혜택을 받을 수 있는 환자도 많게 됩니다. 이러한 신개념 항암제의 등장으로 최근 암 치료는 기존 화학 및 표적항암제에서 면역항암제로 이른바 '패러다임 전환(paradigm shift)'이 이루어지고 있으며, 머크(MSD), BMS, 로슈(Roche), 아스트라제네카(AstraZeneca) 등의 글로벌 제약사들이 신약개발에 성공하여 키트루다®, 옵디보®, 티센트릭® 및 임핀지® 등의 면역관문억제제를 출시해 시장을 주도하고 있습니다.
최근 GlobalData발표에 따르면 면역항암제 시장은 가파르게 성장하여 2019년 290억 달러의 시장규모를 이루었으며, 2026년에는 950억 달러에 이를 것으로 전망되고 있습니다.
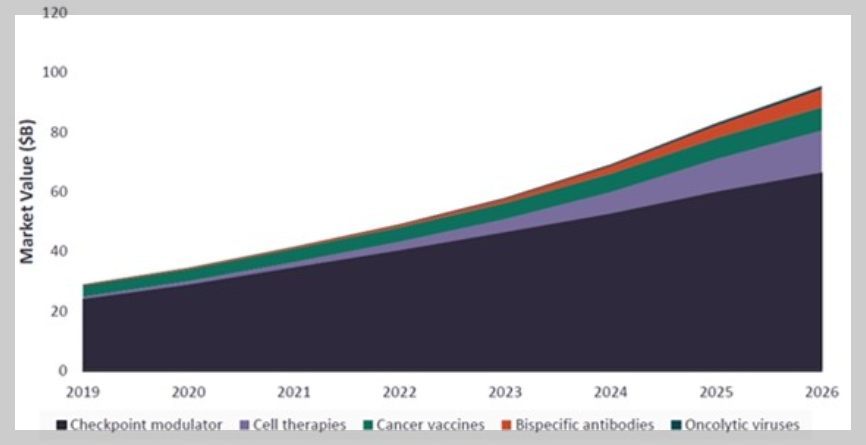
특히 면역관문억제제는 면역항암제 시장에서 가장 성공적인 사례로, GlobalData에 따르면, 면역관문억제제의 글로벌 시장규모는 2019년 기준 239 억 달러로 2018년 대비 36.8% 성장하였으며, 향후 2025 년까지 연평균 14.7 %로 고성장해 글로벌 시장규모 544 억 달러에 이를 것으로 전망되고 있습니다.

면역관문억제제 중에서도 전세계 매출 1위를 차지하는 머크(MSD)의 키트루다®는 흑색종을 대상으로 최초 승인을 획득한 이래 비소세포페암, 두경부암, 호지킨 림프종, 방광암 등 10여개 이상의 다양한 암 적응증에 대부분 1차 치료제로 승인되면서, 2019년 처음으로 단일품목 매출 100억 달러를 넘었으며, 항암제를 넘어서 글로벌 의약품 매출 1위 품목이 되었습니다. EvaluatePharma의 World Preview 2020 자료에 따르면, 키트루다®는 2026년 249억 달러의 매출이 전망되는 바, 여전히 글로벌 매출 1위 품목에 이름을 올릴 것으로 예상되고 있습니다.
이처럼 면역관문억제제를 포함한 글로벌 면역항암제 시장은 매우 성장성이 높은 시장이며, 기존 제제들의 적응증 확대, 병용요법 및 수술 전/후 보조요법으로 적용 방식 확대, 신규 면역항암제의 출시 등으로 인해 지속적으로 고성장할 것으로 전망되며, 경쟁력 있는 제품이 출시될 경우 높은 수익 기대가 가능합니다.
◆알레르기 질환 치료제
알레르기란 우리 몸의 면역 체계가 일반적으로 인체에 해롭지 않은 특정 물질에 대해 불필요한 면역반응을 일으켜 나타나는 질환입니다. 예를 들어 꽃가루나 집먼지 진드기와 같은 외부 원인 물질에 과민반응을 보이게 되며, 반응하는 신체 기관과 원인물질에 따라 그 종류는 매우 다양합니다.
알레르기 질환은 산업화, 서구화된 현대사회에서 증가하고 유병률이 높은 만성 염증성 질환으로 사회 경제적인 비용과 질병 부담이 높은 질환입니다. 비교적 가벼운 증상인 피부 두드러기부터 땅콩 알레르기와 같이 음식에 반응하여 호흡을 곤란하게 하는 것과 같이 생명을 위협할 정도의 심각한 증상을 야기하기도 합니다.
알레르기 질환 치료제로써 증상 완화 목적의 스테로이드, 알레르기 반응의 중간산물을 억제하는 항히스타민제 등의 약물이 많이 사용되고 있으나, 장기간 치료 시 치료 반응성이 저하되는 문제로 최근 천식이나 만성 두드러기 등의 질환에서 더욱 근본적인 원인에 대한 치료가 가능한 면역치료제가 각광받고 있습니다.
알레르기 반응을 시작하는 핵심 물질은 면역글로불린 E(immunoglobulin E, IgE)로, 특정 알레르기를 유발하는 외부 항원에 대해 IgE가 생성되고, 이 IgE가 우리 몸의 혈액이나 장기 내의 알레르기 관련 면역세포의 특정 수용체에 결합해 이들 세포를 활성화하게 됩니다. 활성화된 알레르기 관련 면역세포는 탈과립이라는 과정을 통해 염증매개 물질인 히스타민(histamine) 등을 분비해 가려움증, 부종 및 알레르기 염증 반응을 발생시킵니다. 알레르기 염증반응이 지속되면, 다른 면역세포들도 추가적으로 염증반응이 일어나고 있는 장기로 침투해 과도한 면역반응이 지속되고, 이로 인해 만성적인 조직손상이 발생됩니다
따라서, IgE에 대한 항체를 이용해 IgE가 알레르기 관련 면역세포의 수용체와 결합하는 것을 방해하는 접근법은 알레르기 반응 억제에 매우 유효하게 작용합니다. 항IgE 항체는 핵심 물질인 IgE를 포획하여 알레르기 유발 세포의 활성화와 염증매개 물질의 방출을 억제합니다. 현재 항IgE 항체로서, 로슈(Roche)/노바티스 (Novartis) 사가 2003년 출시한 오말리주맙(제품명: 졸레어®)이 대표적인 약물로 사용되고 있으며, IgE에 대한 결합력이 향상된 항체인 리겔리주맙이 임상 시험을 통해 개발되고 있습니다.
지아이이노베이션은 두 개의 유효성분을 독자적 노하우로 결합한 이중단백질 의약품 및 이중항체 치료제를 개발하고 있으며, 핵심 파이프라인으로서 면역항암제인 GI-101을 보유하고 있습니다. 따라서 면역항암제를 포함한 항암제 시장의 성장과 함께, 최근 병용요법의 개발이 본격적으로 진행되고 있는 개발 트랜드는 지아이이노베이션에게 큰 기회 요인으로 작용합니다. 실제 지아이이노베이션의 주력 제품인 GI-101은 글로벌 제약사인 머크(MSD)의 키트루다® 및 또 다른 글로벌 제약사인 아스트라제네카(AstraZeneca)의 임핀지®와 병용요법을 공동으로 개발하고 있습니다.
지아이이노베이션의 또 다른 주요 파이프라인 GI-301은 알레르기 질환에서 IgE를 포획하는 기능을 유지하면서 기존의 항체 의약품의 부작용을 보완할 수 있는 신규 물질로, 발병률이 증가하며 시장 규모가 확대되고 있는 알레르기 질환 시장에서 충분한 경쟁력을 확보할 수 있습니다.
외부에서 침입한 이물질에 대해 우리 몸의 면역계가 지나친 이상반응을 보이는 알레르기 질환은 눈, 피부, 호흡기관, 위장관 등 다양한 장기에 영향을 미칩니다. 산업화, 서구화 등 생활 환경의 변화로 인한 알레르기 질환 발병률 증가와 함께 알레르기에 관한 관심 및 인식의 확대, 지속적인 치료제 개발 및 출시 등은 알레르기 시장 성장을 빠르게 성장시키고 있습니다.
▶천식치료제 시장규모
천식, 만성 폐쇄성 폐질환 등 호흡기관에 영향을 미치는 만성 알레르기성 질환은 세계보건기구(WHO)에서 분류한 4대 주요 만성 질환에 포함될 만큼 질병 부담이 큰 질환입니다. 2000년 세계보건기구 보고에 따르면, 세계 인구의 약 10%가 천식을 앓고 있으며 십년마다 약 50%씩 증가하는 경향을 보인다고 합니다.
GlobalData 분석에 따르면 글로벌 주요 7개국의 천식 치료제 시장규모는 2019년 98억 달러에서, 2029년 112억 달러에 이를 것으로 전망됩니다. 글로벌 천식 시장에서 70% 이상을 차지하고 있는 미국의 2019년 천식 치료제 시장의 규모는 2019년 70억 달러(71% 점유)이며, 2029년에는 81억 달러 규모(72% 점유)로 확대될 것으로 예상됩니다.

한편, EvaluatePharma의 보고에 따르면, 천식 적응증으로 처방된 오말리주맙(제품명: 졸레어®)의 글로벌 매출액은 노바티스(Novartis)사와 로슈(Roche)사의 매출액 합계로 추산 시 단일약물로 2019년 약 32억 달러에 달합니다. 이후 프리필드 시린지형(pre-filled syringe) 특허 만료, 유럽 물질특허 만료 등으로 2026년에는 22억 달러 수준에 이를 것으로 전망되고 있습니다.

▶만성두드러기 시장규모
두드러기는 전체 인구의 약 20%는 일생에 한 번은 경험할 정도로 매우 흔한 질환이며, 주로 급성 두드러기로 식품, 약물, 감염 등에 의해 일시적으로 나타나며, 해당 원인이 소실되면 호전되는 경과를 보입니다. 반면, 만성 두드러기는 급성 두드러기와 달리 팽진이 6주 이상 거의 매일 나타나며 악화와 호전을 반복, 그 경과를 예측할 수 없습니다. 특히 만성 두드러기 환자의 70~80%에서는 각종 의학적인 조사에도 불구하고 원인을 찾을 수가 없는데 이런 경우 만성 특발성 두드러기(CSU, Chronic Spontaneous Urticaria)로 진단합니다.
만성 두드러기의 경우 발생률은 전 세계적으로 0.5 ~ 1 %로 (출처: Weller K. et al., Hautarzt 2010, 61(9): 750-757), 통증과 가려움증 등으로 인한 수면 장애와 치료제에 대한 이상 반응, 혈관 부종이 동반되는 경우 얼굴이 붓고 입술이 부르트는 등 환자의 삶의 질이 급격히 떨어져, 빠른 진단과 보다 적극적인 치료가 필요한 상황입니다.
국내의 경우 만성 특발성 두드러기에 가장 흔히 처방되는 치료는 ‘항히스타민제+스테로이드’로 스테로이드와 1세대 항히스타민제 처방이 여전히 높지만, 2018년 1월 발표된 글로벌 만성 두드러기 가이드라인에 따라 2세대 항히스타민제 치료 후 효과가 없을 때 졸레어®를 추가하도록 권고하고 있습니다.
GlobalData 자료에 따르면 만성 특발성 두드러기 치료제의 대표품목인 노바티스사의 오말리주맙을 포함하여 상위 10개 치료제의 2020년 글로벌 매출액은 약 49 억 달러이며, 이중 오말리주맙의 매출이 약 33억 달러로 확인됐습니다.

▶아토피 피부염 치료제 시장규모
아토피 피부염은 심한 가려움증과 염증을 동반하는 민성피부질환으로 유병률이 어린이 10~20%, 어른은 1~3%으로 높은 편이며 (출처: Silverberg J., Dermatologic Clinics 2017, 35(3): 283-289), 복잡한 발생 원인으로 인해 환자의 유형 구분에 따라 각기 다른 치료방법이 필요합니다. 이에 따라 현재 시장이 커버하지 못하는 심각한 난치성 아토피 환자에 대한 미충족 수요로 인한 새로운 시장 창출의 기회가 큰 분야입니다.
GlobalData보고에 따르면, 글로벌 주요 7개국 아토피 피부염 치료제 시장 규모는 2017년 약 63.6억 달러를 기록했으며, 2027년에는 183억 달러 규모로 연간 11.1%의 성장률을 보이며 지속적으로 성장할 것으로 예상됩니다.

▶식품알레르기 치료제 시장규모
마지막으로 식품알레르기에 대한 경각심 증가, 유아들의 안전성에 대한 인식, 그리고 증가하는 식품알레르기 사례 등을 이유로, 향후 알레르기 시장에서 가장 잠재적 성장성이 클 것으로 생각되는 분야는 식품알레르기 시장으로 생각되고 있습니다.
특히, 땅콩 알레르기는 단 몇 분 내에 두드러기, 가려움증, 호흡곤란, 메스꺼움 등의 증상을 유발하고, 심할 경우 급성 호흡곤란, 혈압 감소 등의 증상이 나타나는 '아나필락시스'가 발생할 수 있는 질환입니다. 2018년 보고된 GlobalData 자료에 따르면, 주요 8개국 땅콩 알레르기 치료제 시장은 2017년 2,600만 달러 규모에서 연평균 111%의 폭발적인 성장을 보이며 2027년 45억 달러 시장을 형성할 것으로 예측되고 있습니다. 시장에서 가장 큰 비중을 차지하는 지역은 미국으로 전 세계 시장의 약 88%를 점유하고 있습니다.

면역항암제 / 알레르기 치료제의 시장 경쟁 상황
◆면역항암제 GI-101 경쟁 상황
지아이이노베이션이 면역항암제로 선두 파이프라인으로 개발 중인 GI-101은 CD80(CTLA-4를 타겟)과 IL-2 변이체(IL-2 수용체를 타겟)를 포함하는 이중융합 단백질로서, 기전적으로 면역관문 단백질인 CTLA-4 및 인터류킨 단백질 IL-2와 관련되어 있습니다. 현존하는 약물 중 지아이이노베이션의 GI-101과 같이 CTLA-4 및 IL-2 수용체를 동시에 타겟하는 단일 약물은 전무하지만, CTLA-4 또는 IL-2 수용체 각각을 타겟하여 임상 개발 중인 약물들은 아래 표와 같이 존재합니다.
[CTLA-4 및 IL-2(2세대) 제제 개발 현황]
| 타겟 | 성분명(제품명)/특성 | 개발사 | 요법 및 허가/타겟 적응증 | 개발 현황 |
| CTLA-4 | 이필리무맙(여보이®) /CTLA-4 타겟 항체 |
비엠에스 (BMS) |
이필리무맙 단독/병용 요법 고형암 |
2011년 승인 및 출시 |
| 트레멜리무맙 /CTLA-4 타겟 항체 |
아스트라제네카 (AstraZeneca) |
트레멜리무맙 단독/병용 요법 고형암 |
임상3상 진행중 |
|
| FPT155 /CD80-Fc 융합단백질 |
파이브프라임 (Five Prime) |
FPT155 단독요법 고형암 |
임상1상 종료 |
|
| IL-2 (2세대) |
ALKS 4230 /IL-2 융합단백질 |
알케메스 (Alkermes) |
ALKS 4230 + 펨브롤리주맙 병용요법 불응성 난소암 |
임상3상 진행중 |
| RG7461 (simlukafusp alfa) /FAP-IL2 변이체 |
로슈 (Roche) |
R G7461 + 아테졸리주맙 고형암 |
임상2상 종료 |
|
| RG7461 + 아테졸리주맙(티센트릭®) ± 베바시주맙(허셉틴®) 신장암의 1차치료제 |
임상1b상 종료 |
|||
| THOR-707(SAR444245) /Engineered IL-2 |
신톡스 (Synthorx; 사노피 아벤티스 인수합병) |
THOR-707 + 펨브롤리주맙(키트루다®) ± 세툭시맙(얼비툭스®) 소화기계암 |
임상2상 진행중 |
먼저, CTLA-4를 타깃하는 기전의 치료제로는 CTLA-4 항체인 BMS사의 이필리무맙(ipilimumab, 제품명: 여보이®)와 아스트라제네카(AstraZeneca)의 트레멜리무맙(tremelimumab)이 있습니다. 또한 지아이이노베이션과 유사하게 CD80-Fc 융합단백질 형태로 개발되고 있는 파이브프라임사의 FPT155 파이프라인이 있습니다.
이필리무맙(ipilimumab, 제품명: 여보이®)는 2011년 FDA로부터 흑색종 치료제로 허가 받은 후 전이암, 신장암 그리고 대장암까지 치료제 용법을 확장하였고, 현재 흑생종에서 치료 용법으로는 3mg/kg 정맥투여를 매 3주마다 총 4회 투여로 모든 치료과정을 16주 이내에 완료하는 것으로 사용되고 있습니다. 또한 신세포암에서는 이필리무맙(여보이®)와 니볼루맙(PD-1 항체, 옵디보®)의 병용요법으로 허가를 받아 사용하고 있습니다. 단, 이 약은 T 세포 활성화 및 증식으로 인하여 중증 및 사망을 초래하는 이상사례들이 보고된 바 있습니다. 뿐만 아니라 면역매개 반응들로 인해 소장대장염, 간염, 피부염(독성표피괴사를 포함), 신경병증 및 내분비병증 등과 같은 중증반응이 나타날 수 있다는 우려사항이 있는 약물입니다.
다른 CTLA-4 항체로는 아스트라제네카의 트레멜리무맙(tremelimumab)이 있으며, 여보이® 대비 반감기 증가 및 면역글로불린 타입 변경(IgG1 대신 IgG2)으로 기존의 면역매개 부작용을 감소시키는 전략으로 개발 중인 약물입니다. 2015년에 FDA로부터 중피종에서 희귀질환 약물로 승인을 받아 임상개발에 박차를 가하고 있으며, 비소세포성폐암, 간암을 포함한 다양한 고형암에서 더발루맙(PD-L1 항체, 임핀지®)과 병용요법으로 임상 3상에 개발 중에 있습니다. 추후 여보이®의 대체 약물로 사용될 가능성이 높아 보이지만, 기존의 면역매개 부작용 반응에서의 개선 가능여부는 지속적으로 지켜보아야 할 필요가 있는 약물입니다.
또한 파이브프라임사의 FPT155 파이프라인은 지아이이노베이션과 유사하게 CD80-Fc 융합단백질 형태로 개발되고 있는 약물로서, 현재 임상 1상이 종료된 상황입니다. 2020년 학술 발표자료에 따르면 진행성 고형암 환자 대상의 임상 1상 결과에서 560 mg까지 용량 제한 독성이 나타나지 않았고, 약물 투여로 인한 면역 관련 부작용 및 급성 면역 이상 반응(사이토카인 방출 증후군)이 발생하지 않았음을 입증한 바 있습니다. FPT155의 임상 진척에 따라 유효한 항암효과를 보이게 되는 경우, 지아이이노베이션 제품과 잠재적인 경쟁관계가 될 수도 있으나, 지아이이노베이션의 제품은 CD80 외에도 IL-2를 동시에 가지고 있는 물질로 시너지 효과가 기대되고 있어 경쟁제품으로서의 위협은 크지 않을 것으로 예상되며, 오히려 CD80 분자의 면역항암제로의 활용 및 작용 기전에 대한 신뢰성, 안전성을 입증해 줄 수 있는 사례가 될 것으로 사료됩니다.
한편, IL-2 수용체를 타겟하는 치료제와 관련하여, IL-2는 이미 항암치료제로 상용화 되어 있는 유일한 사이토카인으로서 프로류킨®(Proleukin, 성분명: 알데스류킨(aldesleukin))이라는 상표명으로 1992년 FDA로부터 전이성 피부암 및 신장암 치료에 대해 승인을 받아 사용되어 왔습니다. 프로류킨®은 항암 면역 반응에 중요한 T 세포 및 자연살해세포의 활성을 증가시키지만, 짧은 체내 반감기와 항암 면역반응을 억제하는 조절 T 세포의 증가를 유도하는 단점을 가지고 있습니다. 이에 따라 최근 프로류킨®의 단점들을 보완하는 전략으로 IL-2α 수용체에 대한 결합력을 감소시킨 2세대 IL-2 변이체들이 개발 중에 있습니다.
그 중 임상개발 단계의 경쟁 파이프라인으로는 로슈(Roche)의 RG7461, 알케메스(Alkemes)의 ALKS 4230 그리고 신톡스(Synthorx)의 THOR-707가 있습니다. 특히, 이들 IL-2 변이체들은 기존 IL-2 제제의 미충족 수요를 해결하는 시장 내 기대감으로 인해 임상개발 단계에서의 공동연구 및 인수합병이 활발히 진행되고 있습니다.
특히, 다국적 제약사인 사노피는 면역항암제 파이프라인 강화 목적으로, THOR-707 파이프라인을 보유하고 있는 신톡스 사를 2019년 25 억 달러에 인수했습니다. THOR-707(SAR444245)는 차세대 페길화 인터류킨-2로서 현재 임상 2상 진행 중이며, 기존의 인터류킨-2 물질 중에서 가장 좋은 효능을 보일 것으로 기대되는 약물입니다.
이처럼 IL-2변이체 파이프라인의 공동임상개발 및 인수합병 사례들을 살펴볼 때, 선택적인 효과 T 세포의 활성화가 가능한 IL-2 변이체의 면역항암제로의 효용 가능성에 대해 기술 및 시장 측면에서의 기대가 매우 큰 것으로 판단되며, 지아이이노베이션 파이프라인 가치에도 긍정적인 영향을 미칠 것으로 예상합니다.
◆알레르기 치료제 GI-301 경쟁 상황
알레르기 치료에는 주로 약물치료제와 면역치료제가 사용되고 있습니다. 약물치료제는 알레르기 증상을 완화시키는 것을 목적으로 하며, 알레르기의 주요 체내 매개체인 히스타민의 작용을 억제하는 항히스타민제(지르텍, 알레그라, 세티리진 등)와 면역억제 및 항염증 효과가 있어 천식 등 다양한 질환에 사용되고 있는 스테로이드제가 있습니다. 그러나 일부 환자는 이러한 치료로 증상이 조절되지 않아 전신 스테로이드를 반복적으로 사용하게 되며, 그에 따른 스테로이드 부작용이 치료의 부담으로 작용하고 있습니다.
한편, 면역치료제의 원리는 몸에 미량의 알레르기 항원을 장기간에 걸쳐 조금씩 투여해서 면역 체계가 더 이상 특정 알레르기 항원에 과민 반응하지 않게 만들어주는 것입니다. 증상의 완화는 물론 완치의 효과를 볼 수 있으나, 치료 기간이 2-3년 이상 걸리고 비용이 고가이며 한달에 2-4회 주사를 맞아야 하는 등의 어려움이 있습니다.
최근 이에 대한 대안으로서 특정 생체표지자(biomarker)를 타겟하는 다양한 생물학적 제제가 개발되고 임상에 적용됨에 따라 생물학적 제제에 대한 관심이 증가하고 있습니다. 대표적으로 현재 시판 중인 항알레르기 생물학적 치료제로는 오말리주맙(omalizumab, 제품명: 졸레어®) 이외에도, 두필루맙(dupilumab, 제품명: 두피센트®), 레슬리주맙(reslizumab, 제품명: 싱케어®) 등이 있습니다. 또한 임상 개발 중인 치료제로서 리겔리주맙(ligelizumab, QGE031)을 이용한 식품알레르기에 대한 임상 3상이 진행되고 있으며, 그 외 아토피 치료제인 일라이 릴리(Eli Lilly) 사의 레브리키주맙(Lebrikizumab)과 천식 치료제인 암젠(Amgen)/아스트라제네카의 테제페루맙(Tezepelumab) 등이 후기 임상 진행 중입니다.
[항알레르기 생물학적 제제 승인 및 개발 현황]
| 타겟 | 성분명(제품명)/특성 | 업체명 | 개발 현황 | 적응증 |
| IgE | 오말리주맙(졸레어®) / IgE 타겟 항체 |
로슈/ 노바티스 |
2003년 승인 및 출시 | 만12세 이상 중증 천식환자 |
| 리겔리주맙 / IgE 타겟 항체 |
노바티스 | 임상 3상 진행중 | 식품(땅콩) 알레르기환자 | |
| IL-4Rα | 두필루맙(두피센트®) / IL-4Rα 타겟 항체 (IL-4/IL-13 억제) |
사노피/ 리제네론 |
2017년 승인 및 출시 | 만 12세 이상 아토피환자 |
| IL-5 | 레슬리주맙(싱케어®) / IL-5 타겟 항체 |
테바 | 2017년 승인 및 출시 | 만18세 이상 중증 천식 환자 |
| IL-5 | 메폴리주맙(누칼라®) | 글락소스미스클라인 | 2016년 승인 및 출시 | 중증 호산구성 천식 치료 |
| Il-5 | 벤랄리주맙(파센라®) | 아스트라제네카 | 2017년 승인 및 출시 | 12세 이상의 중증 호산구 천식 환자 |
| IL-13 | 레브리키주맙 / IL-13 타겟 항체 |
릴리 | 임상 3상 진행중 (2023년 승인 예상) |
12세이상 중등증 내지 중증 아토피 피부염환자 |
| TSLP | 테제펠루맙 / TSLP 타겟 항체 |
암젠/아스트라제네카 | 임상 3상 완료 (2023년 승인 예상) |
천식치료 및 아토피환자 |
먼저, 로슈(Roche)와 노바티스(Novartis)가 공동개발한 오말리주맙(졸레어®)은 항 IgE 항체로써, 알레르기에서 기전적으로 중요한 IgE를 감소시킴으로써 증상을 완화시키는 약물로 2003년 FDA으로부터 첫 승인을 받았습니다. 초기에 알레르기성 천식 치료 용도로 쓰였으나, 항히스타민제와 스테로이드로도 낫지 않는 중증 만성 두드러기 치료제로 사용 영역이 확대되었습니다. 글로벌 치료제시장의 18%를 차지하고 있으며 연매출은 32억 달러(2020년 기준)입니다. 그러나 오말리주맙은 혈중 IgE 수치가 높은 환자에게서 충분한 치료 효과를 발휘하지 못하는 한계를 가지고 있으며 6세 이하의 소아에게는 사용이 불가능합니다. 또한 물질특허가 2017년에 만료되어 많은 제약사가 바이오시밀러 개발을 진행하고 있으며 국내기업으로는 셀트리온이 2024년 시판을 목표로 오말리주맙 바이오시밀러 개발을 진행 중에 있습니다.
이와 같은 상황에서 노바티스사는 오말리주맙의 기능을 개선하고 적응증을 확대한 후속약물로서 차세대 항 IgE 항체인 리겔리주맙(ligelizumab)을 연구 개발하여 21년 1월에 FDA로부터 만성특발성두드러기 치료제로 혁신치료제(Breakthrough Therapy) 지정을 받았습니다. 리겔리주맙은 오말리주맙에 비하여 IgE와 결합 친화력을 증가시킨 약물로 6주 이상 지속되는 만성특발성두드러기의 주 원인인 IgE와 FcεRI 결합을 억제하는데 더 효과적이며 투여용량을 줄일 수 있는 것으로 알려졌습니다. 그러나 2021년 12월 만성특발성두드러기 임상 3상에서 표준치료제인 오말리주맙 대비 우월성(superiority) 입증에 실패해 임상이 중단되었으며, 현재 리겔리주맙을 이용한 식품알레르기에 대한 임상 3상은 지속되고 있습니다. 그러나, 면역원성이 높고 피하주사 부위 부작용이 빈번하게 발생하여 여전히 이슈가 있을 것으로 생각됩니다.
사노피(Sanofi)와 리제네론(Regeneron)이 공동 개발한 천식 및 아토피 피부염 치료제 두필루맙(두피센트®)은 중증 아토피 환자에게 효과가 클 것으로 기대되는 신약이며, 인터류킨-4 수용체(IL-4Rα) 차단을 통해 아토피 및 알레르기 질환에 관여하는 인터류킨-4와 인터류킨-13의 신호전달을 조절함으로써 알레르기 증상을 완화시킵니다. 두필루맙은 아토피 피부염 환자들 뿐만 아니라 조절이 안되는 지속적인 소아 천식환자들에게서 효과, 호산구성 식도염, 식품·환경 알레르기, 만성 폐쇄성 폐질환(COPD) 및 기타 각종 피부질환 등 2형 염증에 의해 촉발되는 다른 질환들에도 적응증이 확장되고 있습니다. 두필루맙의 연간 치료제 가격은 3만 7,000달러로 알려져 있으며 2020년 매출은 34억 달러입니다. 약물의 우수성과 광범위한 적응증에 효과적이어서 글로벌 알레르기시장에서 급속한 신장세를 올리고 있으며 높은 점유율을 차지하지만, 상대적으로 타제품에 비해 높은 비용이 들며 복잡한 발병원인에 따른 미충족 수요가 여전히 존재하며, 특히 약물의 부작용으로 결막염을 유발하고 있습니다.
테바(TEVA)사의 레슬리주맙(싱케어®)은 호산구의 성숙·생존·활성에 작용하는 사이토카인인 인터류킨-5를 타깃으로 하는 단일클론항체(IgG4 kappa) 약물로 천식에 효과적인 약물입니다. 레슬리주맙은 IL-5에 특이 적으로 결합하여 호산구의 분화, 성숙 및 활성화를 감소시킵니다. 이에 따라 중증 호산구성 천식환자에서 악화율을 줄이고 폐 기능 및 천식을 개선합니다. 가장 흔한 부작용으로는 천식 악화 증상, 비인두염, 상부 호흡기감염, 부비동염, 인플루엔자 및 두통 등이 발생합니다.
추가로 인터류킨-5를 표적으로 항체로 허가받은 제품으로는 글락소스미스클라인(GSK)사의 중증 천식치료제인 메폴리주맙(mepolizumab, 누칼라®)과 인터류킨-5 수용체(IL-5Rα)를 표적하는 항체의약품인 벤랄리주맙(benralizumab, 파센라®) 등이 있습니다. 특히, 벤랄리주맙은 아스트라제네카의 차기 알레르기 주력약물로서, 천식악화와 비인두염 발생률을 최대 51%까지 낮추고 폐기능 개선효과를 입증한 약물로서 향후 IL-5 타깃 제제인 레슬리주맙과 메폴리주맙의 강력한 경쟁 상대로 부상할 것으로 예상됩니다.
릴리가 개발중인 아토피피부염 치료제 레브리키주맙은 인터류킨-13에 대한 친화도를 높이도록 고안된 단클론항체로서, 가려움증, 수면, 전반적인 삶의 질 향상에 효과적인 임상효과를 보이고 있어 듀피센트를 위협할 수 있는 약물로 평가받고 있으며, 2023년 FDA 승인을 목표로 하고 있습니다. 또한 암젠과 아스트라제네카가 공동으로 개발 중인 테제펠루맙(tezepelumab)은 천식을 치료하는 인간 단일클론항체로, 기도염증을 유발하는 중요한 기전으로 보고되는 '흉선 기질상 림포포이에틴(thymic stromal lymphopoietin, TSLP)'에 특이적으로 결합을 하며, 천식이 조절되지 않는 환자를 치료하는 가장 유망한 생물학적 제제로 예상되고 있습니다.
지아이이노베이션은 이러한 기존 IgE 및 사이토카인류를 타겟으로 하는 제품 대비 기전적 차별성을 기반으로 생체 내 IgE를 강력하고 효과적으로 제거함으로써 다양한 IgE 매개 알레르기 질환에 적용 가능한 치료제를 개발하는 것을 목표로 하고 있습니다.
시장 경쟁력
◆독자적 노하우로 두 개의 유효성분을 결합한 이중단백질 및 항체 개발
화학요법제로 대표되는 1세대 항암제부터, 2세대 표적항암제, 3세대 면역항암제에 이르기까지 등장 당시에 각광을 받았던 항암제들이 부작용을 포함한 반응성 저하 등의 약점들을 보이며, 이러한 미충족 의료수요를 보완할 수 있는 방법의 발굴 경쟁이 치열해지고 있습니다. 특히 최근에는 특정한 작용기전과 효능을 보이는 항암제만 단독으로 사용하는 것보다는 작용기전이 상호 보완적인 항암제를 두 개 이상 사용하여 시너지 효과를 극대화시키는 방법이 각광받고 있습니다. 지아이이노베이션은 두 개의 유효성분이 결합된 융합단백질 및 항체를 기반으로 차세대 면역치료제를 연구 개발하고 있으며, 핵심 신약파이프라인인 i) GI-101 면역항암제, ii) GI-301 알레르기 치료제를 비롯한 다양한 면역치료제 신약 파이프라인을 보유하고 있습니다.
지아이이노베이션은 의약/바이오 분야 기초 과학자, 공정개발 전문가 및 임상 개발 전문가 등 바이오 신약 연구개발 및 기술사업화 분야 전문가들로 구성되어 있으며, 이를 바탕으로 융합 단백질 신약 발굴을 위한 플랫폼 기술과 고유의 공정개발 기술, 목표 시장의 미충족 의료 수요에 기반한 임상 개발 역량을 확보하고 있습니다.
◆파이프라인의 다양한 병용요법으로의 사용성 확장
암 치료를 위해 한가지 항암제만 처방하던 단일요법에서 현재는 두 가지 또는 그 이상의 항암제를 동시에 혹은 순차적으로 처방하여 암을 치료하는 병용 요법으로 패러다임이 변해왔습니다. 이제는 선택이 아닌 필수 치료요법으로 자리잡고 있기에 전세계 다수의 제약 및 바이오 기업들은 한층 더 우수한 효능을 위해 새로운 항암제와 기존 항암제들 사이의 최적의 병용요법 개발을 위하여 수많은 연구 및 개발을 진행하고 있습니다. 머크(MSD) 사에서 보유하고 있는 면역관문억제제 키트루다®는 PD-1 억제제로서 2020년 기준 면역항암제 시장에서 매출 1위 ($144억 달러; 한화 약 16.8조원)라는 기록을 세웠습니다. 뿐만 아니라 2017년 국내 면역항암제 허가 1호제로 승인받아 국내에서도 사용되어지는 약물이나, 작년 기준으로 키트루다®는 임상연구에서 가장 비용 부담이 많이 드는 제품 1위가 되었습니다.
지아이이노베이션은 2020년 7월 머크(MSD)사와 면역항암제 병용요법 임상을 위한 협약을 체결하고, MSD로부터 약 200명의 환자들에 대한 키트루다®를 무상으로 지원받는 공동 임상을 진행하게 되었습니다. 이번 임상은 한국과 미국을 포함한 약 20여개의 의료기관에서 실시할 예정입니다. 또한 2021년12월 아스트라제네카사와 GI-101과 항 PD-L1 항체인 임핀지®(더발루맙)과의 이제(doublet) 병용요법 및 GI-101, 임핀지® 그리고 화학항암제와의 삼제(triplet) 병용요법에 대해 공동임상협약을 체결했으며, 현재 아스트라제네카 사와 관련된 임상 디자인을 추가 논의 중입니다. 이와 같이 지아이이노베이션에서 개발 중인 GI-101은 면역관문억제제 이외에도 화학항암제, 표적치료제 및 방사선 치료와의 병용요법과 같은 다양한 병용요법으로 사용성 확장이 가능하여 다른 글로벌 제약사들과도 경쟁구도 보다 협력관계로서 상생할 수 있는 가능성을 가지고 있습니다.
◆기술 이전을 통한 빠른 허가와 시장 진입
지아이이노베이션의 주요 사업모델은 조기 기술이전을 통한 사업화이며, 기존의 치료제 시장에서 함께 시너지 효과를 초래할 수 있는 글로벌 제약사들과 지속적인 논의를 진행하고 있습니다. 지아이이노베이션은 다수의 기술이전 전문가를 영입하여 경쟁력 있는 데이터들을 바탕으로 기술 도입자(licensee) 입장에서 매력적으로 가치 있는 신약으로 평가받기 위해 노력해 글로벌 수준의 선도기업 및 연구자들과의 적극적인 협력과 전임상 등 초기 개발 단계에서의 기술이전 실적을 확보했습니다.
2019년 11월, 지아이이노베이션은 면역항암제 GI-101의 중국 지역(홍콩, 마카오, 대만 포함) 에서의 독점적 개발 및 상업화 권리를 관련하여 중국제약사 심시어(Simcere) 사와 7억 9천만달러의 기술 수출 계약을 체결했습니다. 중국 Top 10 혁신 개발 제약 기업 중 하나인 심시어 사는 중국 난징에 본사를 둔 연구개발(R&D) 중심의 제약기업으로, 2007년 중국 제약 바이오 기업 중 미국 뉴욕증권거래소(NYSE)에 상장한 첫 회사입니다. 또한, 2020년 7월에는 유한양행과 GI-301에 대한 공동 연구개발과 기술 이전 계약을 체결했습니다. 유한양행은 긴 역사를 가진 국내 전통 제약기업으로, '레이저티닙' 신약 파이프라인 하나만으로 국내 바이오 제약 기업 중 첫 누적 기술 수출료(계약금 제외) 1억 달러를 달성한 기업입니다. 본 계약에서 지아이이노베이션은 GI-301에 대한 전세계(일본 제외)에서의 개발 및 사업화 권리를 유한양행에 이전하였으며, 계약규모는 로열티를 제외하고 계약금 200억원을 포함하여 총 14,090억원입니다.
주요 제품
◆ 주요 제품 등의 현황 및 매출실적
(단위 : 천원)
| 제 품 명 | 생산 (판매) 개시일 |
주요 상표 | 2022년 반기 매출액 (비율) |
제 품 설 명 |
| GI-101 | - | - | - | 이중융합단백질 면역항암제인 GI-101은 T 세포 및 자연살해세포 증식 및 활성화시킬 수 있는 IL-2 변이체와 면역관문인 CTLA-4를 저해하는 CD80이 지속형 단백질 형태로 결합되어 있습니다. GI-101은 이중 특이성으로 뛰어난 항암면역 작용을 나타냅니다. |
| GI-301 | - | - | - | 지속형 단백질 알레르기 치료제 GI-301은 알레르기, 두드러기, 천식 등의 과민성 면역 반응을 일으키는 IgE의 활성을 효과적으로 저해하면서도 부작용을 최소화한 지속형 단백질입니다. |
| GI-10N | - | - | - | 차세대 다중항체 및 다중융합단백질인 GI-10N 시리즈의 선두물질인 대사면역항암제로, 종양미세환경의 면역억제를 해소하고 T 세포 및 자연살해세포의 증식/활성화를 유도하여 항암면역 작용을 나타냅니다. |
| 합 계 | - | - | ||
◆ 파이프라인 현황

◆ GI-SMART™ 플랫폼 기술
단백질 신약 후보물질 발굴하여 효과적으로 생산세포주까지 생산할 수 있게하는 고효율 스크리닝 시스템 (High Throughput Screening System) 입니다.
개별 유전자의 접합 부위를 레고 블록화한 것으로 이중융합단백질 제작에 들어가는 시간과 비용을 획기적으로 줄였습니다.
최적의 이중융합단백질을 제작하기 위한 시스템으로 41개 hinge, 10개 Fc, 59개 linker 라이브러리를 구축할 수 있습니다.
이를 통해 제작된 최대 24,190 개의 이중융합단백질 변이체 중 최적의 후보물질을 고효율 스크리닝 할 수 있습니다.

◆ GI-SMARTab™ 플랫폼 기술
최적의 이중융합단백질을 제작하는 GI-SMART™ 플랫폼 기술에서 더 나아가, 이중융합단백질 내에 최적 항체 절편을 도입하여 제작할 수 있게한 플랫폼 기술입니다.

◆ GI-101
신규 이중융합단백질로 설계된 면역항암제


◆ GI-301
융합단백질로 설계된 IgE 매개 알레르기 치료제


주요 계약 및 연구개발활동
◆ 주요계약
2022년 08월 16일 현재 지아이이노베이션이 체결 중인 라이선스 아웃(License-out) 계약의 현황은 아래와 같습니다.
| 품목 | 계약 상대방 | 대상 지역 | 계약내용 | 계약 체결일 | 계약 종료일 |
총 계약 금액 | 수취 금액 | 진행 단계 |
| GI-101 | Simcere Pharmaceutical Co., Ltd. | 중국, 홍콩, 마카오, 대만 | 독점적 개발 및 상업화 권리 | 2019.11.28 | 특허 만료일 |
총 7억9천만USD(계약금 및 개발, 상업화 마일스톤 포함) | 양사 합의하에 비공개 | Pre-IND (중국) |
| GI-101 | ㈜지아이셀 | 한국 | 면역세포치료제와의 병용에 한정하여 치료, 진단, 예방 용도에 대한 전용실시권 | 2019.07.15 | 특허 만료일 |
총 83억원(계약금 2억원 및 개발 마일스톤 포함, 상업화 마일스톤 별도) | 2억원 | 비임상 |
| 전세계 | 면역세포치료제 제조공정 용도에 대한 전용실시권 | |||||||
| GI-301 | ㈜유한양행 | 전세계 (일본 제외) |
전용실시권 | 2020.07.01 | 특허 만료일 |
총 1조 4,090억원(계약금 200억원 및 개발, 상업화 마일스톤 포함) | 165억원(*) | 임상1상 (대한민국) |
(*)2022년 7월 잔여 계약금 35억원을 일시 수령하였습니다.
▶품목: GI-101
| 1. 계약상대방 | Simcere Pharmaceutical Co., Ltd (중국) |
| 2. 계약내용 | 중국지역(홍콩, 마카오, 대만포함)에서의 대상기술에 대한 독점적 개발 및 상업화 권리 |
| 3. 대상지역 | 중국, 홍콩, 마카오, 대만 |
| 4. 계약기간 | 계약체결일: 2019.11.28 계약종료일: 계약일로부터 국가별 청구권이 있는 마지막 특허의 만료일 |
| 5. 총 계약금액 | USD 790,000,000 / 경상로열티 별도 |
| 6. 수취금액 | <반환의무 없는 금액> 계약금(Upfront Payment) 일부 2020년 1월 수취 |
| 7. 계약조건 | 계약금: 양사 합의하에 비공개 (반환의무 없음) 마일스톤 기술료: 임상개발, 허가 및 상업화, 매출에 따른 단계별 마일스톤 수취 예정 경상로열티: 순매출액에 따라 로열티 수취 예정 |
| 8. 회계처리방법 | 라이센스 계약 시점에 계약금 수익처리(양사 합의하에 금액 비공개) |
| 9. 대상기술 | CD80과 IL2v를 포함하는 이중융합단백질 |
| 10. 개발진행경과 | Pre-IND(중국) |
| 11. 기타사항 | - |
| 1. 계약상대방 | ㈜지아이셀(대한민국) |
| 2. 계약내용 | 국내지역에서의 면역세포치료제와 GI-101의 병용투여에 대한 전용실시권에 대한 계약 전세계지역에서의 면역세포치료제의 제조공정에 GI-101의 사용에 대한 전용실시권에 대한 계약 |
| 3. 대상지역 | 면역세포치료제와 GI-101의 병용투여에 대한 전용실시권 (국내) 면역세포치료제의 제조공정에 GI-101의 사용에 대한 전용실시권(전세계) |
| 4. 계약기간 | 계약체결일: 2019.07.15 계약종료일: 계약일로부터 국가별 청구권이 있는 마지막 특허의 만료일 |
| 5. 총 계약금액 | KRW 8,300,000,000 / 상업화 단계의 마일스톤 별도, 경상로열티 별도 |
| 6. 수취금액 | <반환의무 없는 금액> 계약금(Upfront Payment) : KRW 200,000,000 (2019년 7월 수취) |
| 7. 계약조건 | 계약금: KRW 200,000,000 (반환의무 없음) 마일스톤 기술료: 임상개발, 허가에 따른 단계별 마일스톤 총 KRW 8,100,000,000 수취 예정 /상업화 단계의 마일스톤 별도 경상로열티: 순매출액에 따라 로열티 수취 예정 |
| 8. 회계처리방법 | 라이센스 계약 시점에 계약금 2억원 수익처리 |
| 9. 대상기술 | CD80과 IL2v를 포함하는 이중융합단백질 |
| 10. 개발진행경과 | 비임상 |
| 11. 기타사항 | - |
▶품목: GI-301
| 1. 계약상대방 | ㈜유한양행(대한민국) |
| 2. 계약내용 | GI-301에 대한 공동연구 및 전세계 지역(일본 제외)에서의 전용실시권 계약 |
| 3. 대상지역 | 일본을 제외한 전세계 지역 |
| 4. 계약기간 | 계약체결일 : 2020.07.01 계약종료일 : 계약체결일부터 특허의 최종 만료일까지 |
| 5. 총 계약금액 | 금 14,090억원 / 경상로열티 별도 |
| 6. 수취금액 | <반환의무 없는 금액> 계약금(Upfront Payment) : 금 200억원 (금 200억원 중 금 110억원 2020년 7월 수취, 금 55억원 2021년 8월 수취, 금 35억원 2022년 7월 수취) |
| 7. 계약조건 | 계약금: 금 200억원 (반환의무 없음) 마일스톤 기술료: 임상개발, 허가 및 상업화, 매출에 따른 단계별 마일스톤 총 금 13,890억원 수취 예정 경상로열티: 순매출액에 따라 로열티 수취 예정 |
| 8. 회계처리방법 | 라이센스 계약 시점에 계약금 110억원, 임상1상 승인시점에 55억원 일시 수익처리 |
| 9. 대상기술 | 알레르기 질환 치료제 'GI-301' |
| 10. 개발진행경과 | 임상1상(대한민국) |
| 11. 기타사항 | - |
◆ 라이센스 인(License-in) 계약
| 기술/제품 명칭 | 계약 상대방 | 대상 지역 |
계약 체결일 |
계약 종료일 |
총 계약 금액 | 지급 금액 |
진행 단계 |
| 다중항체 또는 다중융합단백질 의약품 | ㈜와이바이오로직스 | 전세계 | 2020.06.22 | (주1) | (주1) | (주1) | (주1) |
(주1) 계약 세부내용의 경우 영업기밀에 해당되므로 이에 계약 세부 내용을 기재하지 않았습니다.
▶품목: 다중항체 또는 다중융합단백질
| 1. 계약상대방 | ㈜와이바이오로직스(대한민국) |
| 2. 계약내용 | 인간항체 서열에 관한 특허권자/출원인인 와이바이오로직스가 기술도입자인 지아이이노베이션에 다중항체 또는 다중융합단백질을 개발하고 사업화 할 수 있는 통상실시권을 부여 |
| 3. 대상지역 | 전세계 |
| 4. 계약기간 | 계약체결일 : 2020.06.22 계약종료일 : 양사 합의에 의해 비공개 |
| 5. 총 계약금액 | 양사 합의에 의해 계약 규모 비공개 |
| 6. 지급금액 | 양사 합의에 의해 계약 규모 비공개 |
| 7. 계약조건 | 양사 합의에 의해 계약 규모 비공개 |
| 8. 회계처리방법 | 라이센스 계약 시점에 지급한 계약금 지급수수료 비용처리 |
| 9. 대상기술 | 항체서열 4종 |
| 10. 개발진행경과 | 후보물질발굴 단계 |
| 11. 기타사항 | - |
◆ 공동연구개발 계약
| 품목 | 계약 상대방 |
대상 지역 | 계약내용 | 계약 체결일 | 계약 종료일 | 총 계약 금액 | 수취 금액 | 진행 단계 |
| 대사면역 항암제 (GI-10N) |
㈜메디라마 | 양사 합의하에 비공개 | 항체 서열 2종의 전부 또는 일부를 포함한 다중항체 또는 다중융합단백질의 공동 연구·개발, 상업화 | 2021.12.07 | 양사 합의하에 비공개 | 양사 합의하에 비공개 | 양사 합의하에 비공개 | 양사 합의하에 비공개 |
▶품목: 대사면역항암제(GI-10N)
| 1. 계약상대방 | ㈜메디라마(대한민국) |
| 2. 계약내용 | 지아이이노베이션이 소유하거나 실시권 허여할 수 있는 항체 서열 2종의 전부 또는 일부를 포함한 다중항체 또는 다중융합단백질을 공동으로 연구·개발, 상업화함 |
| 3. 대상지역 | - |
| 4. 계약기간 | 계약체결일 : 2021.12.07 계약종료일 : 양사 합의에 의해 비공개 |
| 5. 총 계약금액 | 양사 합의에 의해 계약 규모 비공개 |
| 6. 지급금액 | 양사 합의에 의해 계약 규모 비공개 |
| 7. 계약조건 | 양사 합의에 의해 계약 규모 비공개 |
| 8. 회계처리방법 | 의약품 후보물질 선정 시점에 수취한 계약금 수익처리 |
| 9. 대상기술 | 의약품 후보물질 2건 |
| 10. 개발진행경과 | 비임상 |
| 11. 기타사항 | - |
◆ 연구개발 실적
| 구분 | 품목 | 연구기관 | 기대효과 |
| 항암제 | GI-101 | 단독 | 면역관문인 CTLA-4와 사이토카인인 IL-2를 동시에 타깃하는 세계 최초 first-in-class 신약으로 임상 데이터를 기반으로 중국 심시어(7억9천만달러)사에 이어 글로벌 기술이전 체결 예상 |
| 알레르기 치료제 | GI-301 | +유한양행 | 다양한 알레르기 질환에 적용 가능한 IgE를 타깃으로 하는 융합단백질로 유한양행에서 국내 임상 1상 진행 중이며, 향후 일본 지역에 대한 기술이전 체결 예상 |
| 항암제 | GI-10N | 단독 | 차세대 항암 다중융합단백질 및 항체를 개발 중으로, 향후 글로벌 기술이전을 목표로 함 |
| NASH 치료제 | GI-20N | 단독 | 지아이이노베이션 플랫폼을 활용하여 현재 개발 트렌드에 적합한 이중, 삼중 타깃을 가진 NASH 치료제를 개발 중이며, AI 기업인 루닛의 '루닛 스코프'를 통해 NASH 환자 간 조직의 지방간, 간 섬유화 등 정략화 시스템 구축 |
| 알레르기 치료제 | GI-30N | 단독 | 다양한 알레르기 질환 치료제를 개발 중으로, 향후 글로벌 기술이전을 목표로 함 |
▶GI-101
| 구분 | GI-101 |
| 적응증 | 고형암 |
| 작용기전 | - GI-101은 CD80에 의해서 면역관문인 CTLA-4의 작용을 억제해 체내 면역 작용을 재활성화 시킴. 또한, IL-2 변이체에 의해서 항암 면역작용을 나타내는 세포독성 T 세포 및 자연살해세포를 증식 및 활성화시켜서 항암치료의 상승효과를 나타낼 수 있음 - 전임상 단계에서 GI-101이 TPP*(목표제품특성)를 충족 *TPP: GI-101 단독/방사선과 병용요법/VEGF 억제제와 병용요법/면역관문억제제와 병용요법 |
| 제품의 특성 | - GI-101은 GI-SMART™기술을 이용해 최초로 제작된 이중융합 단백질로 CTLA-4의 저해와 IL-2 수용체의 자극을 통한 복합적인 면역활성 효과를 나타낼 수 있는 세계 최초의 first-in-class 신약 - 높은 제품 안정성과 고생산성 및 고순도의 안정된 생산 공정(CDMO) 확보 및 역량 활용 - GI-101 물질 및 용도 특허 등록 |
| 진행경과 | - GI-101 단독 요법만으로 항암효과를 갖으며, 항 PD-1 항체 및 혈관내피세포성장인자(vascular endothelial growth factor; VEGF) 억제제 뿐만 아니라 방사선 요법과 함께 병용 투여 시 더욱 효과적인 약리 효능을 보이는 것을 동물모델에서 확인 - 원숭이 및 랫트를 이용한 독성 실험에서 안전성 확인 - GMP 생산 시스템 확보, 안정적으로 높은 순도의 물질 생산 확인 - 비임상 단계로 L/O 계약 체결 - 한국 임상1/2상 IND(임상시험계획) 승인 (2021.04) - 미국 임상1/2상 IND(임상시험계획) 승인 (2021.06) - 한국 임상1/2상 진행 중 |
| 향후계획 | - 미국 임상1/2상 진행 - 글로벌 제약사와 라이선스 아웃 계약 추진 (GI-101 전세계 판권) |
| 경쟁제품 | - 사노피(Sanofi)의 THOR-707 |
| 시장규모 | 글로벌 면역항암제 시장은 키트루다®, 옵디보®, 티센트릭®, 임핀지® 등 면역관문억제제들의 적응증 확대, 킴리아®, 예스카타® 등 CAR-T 치료제의 출시, 병용요법 및 수술 전/후 보조요법으로 적용 방식 확대, 신규 면역항암제의 출시 등으로 인해 지속적으로 고성장할 것으로 전망. 특히 면역관문억제제는 항암 약물 시장에서 가장 성공적인 사례로, 글로벌데이터에 따르면, 면역관문억제제 글로벌 시장규모는 2019년 기준 239 억 달러로(2018년 대비 36.8%의 성장), 향후 2025년까지 연평균 14.7%로 고성장해 2025년에는 글로벌 시장규모 544억 달러에 이를 것으로 전망되고 있음 |
| 관련논문 | - GI101, a novel triple-targeting bispecific CD80-IgG4-IL2variant fusion protein, elicits synergistic anti-tumor effects in preclinical models(ESMO 2019) - GI101, A novel CD80-IgG4-IL2 variant bispecific protein, inhibits tumor growth and induces anti-tumor immune response in multiple preclinical models(AACR 2020) - Comprehensive preclinical study on GI-101, a novel CD80-IgG4-IL2 variant protein, as a therapeutic antibody candidate with bispecific immuno-oncology target(AACR 2021) |
▶GI-301
| 구분 | GI-301 |
| 적응증 | 알레르기 질환(아토피 피부염, 알레르기 비염, 천식 등) |
| 작용기전 | - 알레르기 질환을 유발하는 핵심인자인 IgE에 높은 결합력으로 부착하여, 체내 IgE 수용체와의 결합을 방해함 - GI-301은 IgE와의 결합에 있어 오말리주맙에 비해 약 75배 강력한 결합력을 보이며 결합 후 해리가 잘 일어나지 않아, 졸레어® 대비 더 적은 양으로 더 오랜 약물효과 지속기간을 가질 수 있음 - IgE와 CD23(FcεRII)의 결합을 졸레어®와 동등하게 효과적으로 차단한다는 것을 확인 - 원숭이, 개, 마우스 등 여러 동물 군의 IgE에도 결합력 보유 - 만성 특발성 두드러기 환자의 혈청에서 IgE를 효과적으로 감소시킴을 확인 |
| 제품의 특성 | - GI-301은 인간 IgE에 높은 결합 친화력을 가지는 FcεRI α 사슬의 ECD를 이용해, 생체 내 내재성(endogenouse) FcεRI와 IgE의 결합을 효과적으로 저해하여 IgE에 의해 매개되는 알레르기 질환을 효과적으로 타깃 - IgE의 FcεRI 결합을 방해할 뿐만 아니라, FcεRI에 대한 자가항체의 기능을 저해함으로써 만성 특발성 두드러기의 발병을 억제 |
| 진행경과 | - IgE에 대한 결합력이 졸레어®보다 약 75배 이상 높고 결합이 지속적으로 유지되어 비만세포의 탈과립억제 능력 탁월함 - 원숭이 실험에서 기저 IgE 레벨이 1,000 IU/ml이상인 개체에서도 단회 투여 후 약 7일 동안 IgE를 완전히 억제함 - 특발성 두드러기 환자에서 자가 FcεRI 항체와 결합하여 비만세포의 탈과립 방지 가능 - 부작용 우려 낮음 - 한국 임상1상 IND 승인 (2021.07) - 한국 임상1상 진행 중 |
| 향후계획 | - GI-301 비임상 연구에서 졸레어®, 리겔리주맙이 가지고 있는 여러 한계를 극복할 수 있음을 확인한 바, 실제 임상에서 관련 내용 확인 예정. - GI-301 라이선스 아웃 계획 추진(일본 지역) |
| 경쟁제품 | -로슈(Roche)/노바티스(Novartis)의 졸레어®(오말리주맙), 노바티스(Novartis)의 리겔리주맙(임상 3상) |
| 시장규모 | 글로벌데이터에 따르면 글로벌 주요 7개국의 천식 치료제 시장규모는 2019년 98억 달러에서, 2029년 112억 달러로 확대 예상. 글로벌 천식 시장에서 70% 이상을 차지하고 있는 미국의 2019년 천식 치료제 시장의 규모는70억 달러이며, 2029년에는 81억 달러에 이를 것으로 전망. 만성특발성두드러기 치료제의 대표품목인 노바티스사의 오말리주맙을 포함하여 상위 10개 치료제의 2020년 글로벌 매출액은 약 49 억 달러이며, 이 중 오말리주맙의 매출이 약 33억 달러로 확인. 글로벌 주요 7개국 아토피 피부염 치료제 시장 규모는 2017년 약 63.6억 달러를 기록했으며, 2027년에는 183억 달러 규모로 연간 11.1%의 성장률을 보이며 지속적으로 성장할 것으로 전망. 주요 8개국 땅콩 알레르기 치료제 시장은 2017년 2600만 달러 시장에서 연평균 111%의 폭발적인 성장을 보이며 2027년 45억 달러 시장을 형성할 것으로 예측. |
| 관련논문 | - The Novel Long-Acting IgE Trap-Fc Fusion Protein GI301 Elicits Therapeutic Synergy In Combination with Probiotics For The Treatment Of Food Allergy (The European Academy of Allergy and Clinical Immunology (EAACI) Congress 2019) - GI-301: a novel long-acting IgE Trap-Fc fusion protein for IgE-mediated allergic diseases (UCARE CONFERENCE 2019) |
◆ 정부과제 수행실적
(단위: 천원)
| 연구과제명 | 주관부서 | 연구기간 | 정부출연금 | 비고 |
| 맞춤형 SMART-Selex™ 플랫폼 기술기반의 3중 타겟 GI-101의 임상시험 및 제품화 | 한국보건산업진흥원 | 2019.05.10~ 2020.12.31 |
400,000 | 연구자 주도 질병극복연구 |
| In silico 기반 분석을 통한 한약 유래 항혈관신생 선도 물질의 가상 검색과 그 치료효과 검증에 대한 연구 (주1) | 한국 연구재단 |
2017.03.01~ 2020.02.29 |
399,740 | 신진연구 지원사업 |
| T 세포 기반의 범용 인플루엔자 백신 비임상시험 및 유효성 평가 (주2) | 한국보건산업진흥원 (백신실용화 기술개발사업단) |
2020.10.06~ 2022.12.31 |
330,000 | 감염병 예방ㆍ치료 기술개발 사업 |
| 진행성 또는 전이성 고형암 환자를 대상으로 GI-101 단일요법 및 GI-101과 pembrolizumab, lenvatinib 또는 국소 방사선 병용요법의 안전성, 내약성, 약동학 및 치료효과를 평가하기 위한 제1/2상, 공개, 용량증량 및 확장 임상시험 | 한국연구재단, 한국산업기술평가관리원, 한국보건산업진흥원 (국가신약개발사업단) |
2022.03.01~ 2023.12.31 |
3,500,000 | 국가신약 개발사업 |
주1) 해당 정부과제는 연구책임자의 소속 기관변경으로 인해 동국대학교 경주캠퍼스 산학협력단에서 지아이이노베이션으로 이관해 온 건입니다.
주2) 해당 정부과제는 지아이이노베이션이 세부기관으로 참여하여 주관연구기관과 공동개발하는 건으로서 세부기관에 할당된 정부출연금을 기준으로 기재하였습니다.
매출 및 수주상황
◆ 매출 실적
지아이이노베이션의 주요 수익 모델은 국내외 제약사들과 지아이이노베이션 보유 파이프라인에 대한 기술이전 및 공동개발에 대한 라이선스 아웃(License-out) 계약을 체결하고 그 과정에서 기술선급료 및 마일스톤 달성에 따른 로열티를 수령하도록 체계화되어 있으며, 제품화 성공 이후에는 매출액의 일정 부분에 대하여 로열티 수익을 창출하는 구조로 되어 있습니다.
(단위 : 천원,%)
| 매출유형 | 품 목 | 구분 | 2022년 반기 (제6기 반기) |
2021년 (제5기) |
2020년 (제4기) |
||||||
| 수량 | 금액 | 비중 | 수량 | 금액 | 비중 | 수량 | 금액 | 비중 | |||
| 기술이전 | GI-101 | 수출 | - | - | - | - | - | - | - | - | - |
| 기술이전 | GI-101 | 내수 | - | - | - | - | - | - | - | - | - |
| 기술이전 | GI-301 | 내수 | - | - | - | - | 5,500,000 | 98.20 | - | 11,000,000 | 99.85 |
| 공동연구 | GI-10N | 내수 | - | - | - | - | 100,000 | 1.80 | - | - | - |
| 기타용역 | 용역매출 | 내수 | - | - | - | - | - | - | - | 16,789 | 0.15 |
예비심사청구개요
| 심사청구일 | 2022.04.20. |
| 상장(예정)주식수 | 22,004,200 주 |
| 공모(예정)주식수 | 2,000,000 주 |
| 상장주선인 | 하나증권주식회사, 엔에이치투자증권주식회사, 삼성증권 |
| 감사인 | 삼덕회계법인 |
회사개요
| 회사명 | [코스닥] 지아이이노베이션 | 회사영문명 | GI Innovation Inc. |
| 설립일 | 2017. 07. 19. | 국적 | 대한민국 |
| 대표이사 | 홍준호 | 대표전화 | |
| 종업원수 | 97 명 | 홈페이지 | https://www.gi-innovation.com/ |
| 업종 | 자연과학 및 공학 연구개발업 | 기업구분 | 벤처 |
| 주요제품 | 면역항암제 및 알레르기 치료제 | ||
| 본점소재지 | 서울특별시 송파구 송파대로 167 | ||
| 결산월 | 12월 | 주당액면가 | 500 원 |
| 매출액(수익) | 5,600 (백만원) | 법인세차감전계속사업이익 | -150,742 (백만원) |
| 순이익 | -150,742 (백만원) | 자기자본 | 170,431 (백만원) |
| 최대주주 | 장명호 | 최대주주 지분율 | 8 % |
| 자회사의 주요제품 (지주회사일 경우) |
|||
심사결과

IPO준비를 진행 중이거나 신규 상장한 기업을 이해하기 위한 목적이며, 투자 권유를 목적으로 하지 않습니다.
투자에 관한 결정은 투자자 본인에게 있으며 그 책임 또한 본인에게 있습니다.
'주식투자 > 2022년 IPO' 카테고리의 다른 글
| [2022년 IPO 예비심사기업] 수산인더스트리(SOOSAN INDUSTRIES CO., LTD.) (2) | 2022.10.10 |
|---|---|
| [2022년 IPO 예비심사기업] 플라즈맵(Plasmapp Co., Ltd.) (1) | 2022.10.07 |
| [2022년 IPO 예비심사기업] 이노룰스(INNORULES CO.,LTD) (1) | 2022.10.05 |
| [2022년 IPO 예비심사기업] 오픈엣지테크놀로지(Openedges Technology, Inc.) (2) | 2022.10.04 |
| [2022년 IPO 예비심사기업] 모델솔루션(Model Solution Co., Ltd.) (2) | 2022.10.03 |