2024년 신규상장 IPO기업 아이엠비디엑스 주식회사(IMBdx Inc.)에 대해 알아보자.

자연과학 및 공학 연구개발업 - 아이엠비디엑스 -
아이엠비디엑스는 혁신적인 액체생검 기술에 기반하여 암발생 전주기에 걸쳐 환자 맞춤형 정밀의료 및 조기진단을 가능하게 함으로써 암정복에 도전하는 글로벌 헬스케어 기업입니다. 아이엠비디엑스의 주요 사업분야는 진행암의 정밀진단 및 치료, 수술 후 재발 조기탐지, 그리고 암 조기진단 등의 3가지로 구성됩니다.
1. 예비심사청구 및 회사개요
1) 예비심사청구 개요
▶ 심사청구일 : 2023.08.29.
▶ 상장(예정) 주식수 : 13,992,625 주
▶ 공모(예정) 주식수 : 2,500,000 주
▶ 상장주선인 : 미래에셋증권 주식회사
▶ 감사인 : 대주회계법인
2) 회사 개요
| 회사명 | [코스닥] 아이엠비디엑스 | 회사영문명 | IMBdx Inc. |
| 설립일 | 2018. 07. 05. | 국적 | 대한민국 |
| 대표이사 | 김태유, 문성태 | 대표전화 | |
| 종업원수 | - 명 | 홈페이지 | https://www.imbdx.com/ |
| 업종 | 자연과학 및 공학 연구개발업 | 기업구분 | 벤처 |
| 주요제품 | 알파리퀴드ⓡ 100, 알파리퀴드ⓡ HRR, 알파리퀴드ⓡ 디텍트, 알파리퀴드ⓡ 스크리닝 | ||
| 본점소재지 | 서울특별시 금천구 가산디지털1로 131 A동 21층(가산동, BYCHIGHCITY) | ||
| 결산월 | 12월 | 주당액면가 | 100 원 |
| 매출액(수익) | 2,625 (백만원) | 법인세차감전계속사업이익 | -10,436 (백만원) |
| 순이익 | -10,436 (백만원) | 자기자본 | -31,132 (백만원) |
| 최대주주 | 김태유 | 최대주주 지분율 | 16 % |
2. 공모 일정 및 내용
1) 공모개요
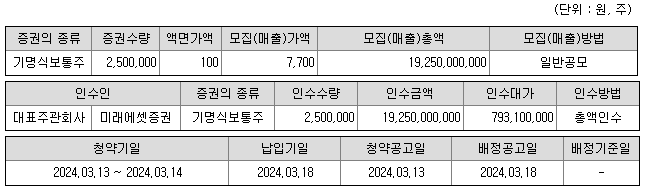
- 주당 모집(매출)가액, 모집(매출)총액, 인수금액, 인수대가 등은 대표주관회사와 발행회사가 협의하여 제시한 공모희망가액인 7,700원 ~ 9,900원 중 최저가액(하단)인 7,700원 기준입니다. 참고로, 공모희망가액의 최고가액(상단)인 9,900원 기준 모집(매출)총액은 24,750,000,000원입니다.
- 일반 / 기관 청약자 청약일: 2024년 03월 13일(수) ~ 14일(목)(2일간)
2) 공모방법
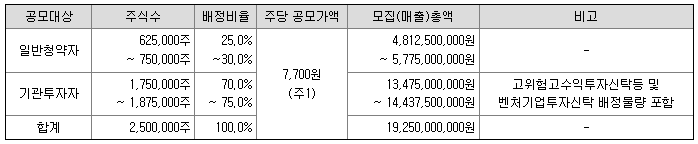
<일반공모>

<청약대상자 유형별 공모대상 주식수>
3) 수요예측 공고 및 수요예측 실시
| 구분 | 내용 |
| 공고 일시 | 2024년 03월 04일(월) |
| 기업 IR | 2024년 02월 28일(수) ~ 2024년 03월 08일(금) |
| 수요예측 일시 | 2024년 03월 04일(월) ~ 2024년 03월 08일(금) |
| 공모가액 확정공고 | 2024년 03월 12일(화) |
- 수요예측 안내공고는 2024년 03월 04일(월) 대표주관회사인 미래에셋증권㈜의 홈페이지(https://securities.miraeasset.com) 에 게시함으로써 개별통지에 갈음합니다.
- 수요예측 마감시각은 한국시간 기준 2024년 03월 08일(금) 17:00 임을 유의하시기 바랍니다. 수요예측 마감시각 이후에는 수요예측 참여, 정정 및 취소가 불가능하오니 접수마감시간을 엄수해 주시기 바랍니다.
4) 보유지분의 상장 후 의무보유 기간 연장(보호예수)
상장예정주식수(보통주) 13,992,625주 중 3,001,543주(공모 후 21.45%)는 상장 직후 시장에서 유통가능한 물량에 해당합니다. 상장 후 이러한 유통가능 물량의 출회로 주식가격이 하락할 수 있으며, 의무보유가 종료되면 해당 물량의 출회로 추가적으로 주가가 하락할 수 있으니 투자자께서는 유의하시기 바랍니다.
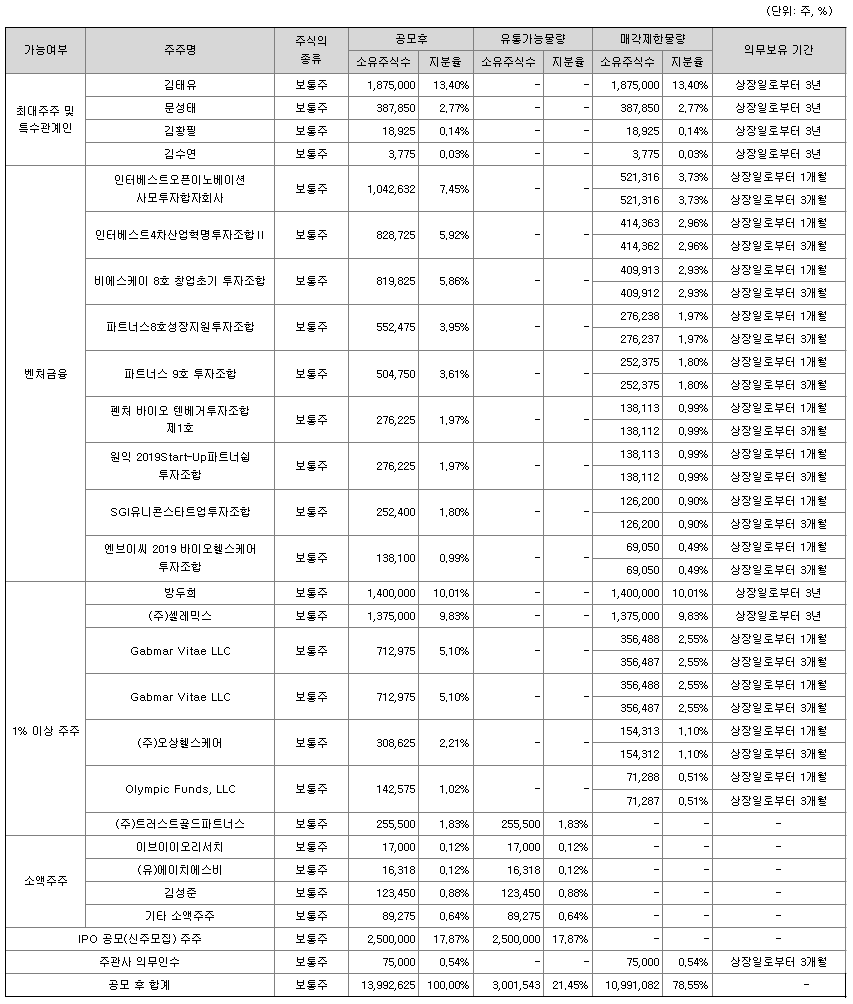
금번 공모예정주식을 포함한 아이엠비디엑스의 상장예정주식수(보통주) 13,992,625주 중 최대주주인 김태유 및 특수관계인인 문성태, 김황필, 김수연이 보유한 2,285,550주(공모 후 16.33%)는 「코스닥시장 상장규정」제26조제1항제1호에 의거한 기술성장기업으로 상장일로부터 1년간 의무보유 설정되며, 제26조제1항 본문의 단서 조항에 따라 자발적으로 2년간 의무보유 기간을 추가하여, 총 3년간 의무보유할 예정입니다.
상장 이후 급격한 주가 변동 방지 및 안정적인 주가 흐름 형성 등을 통한 투자자 보호 조치 차원에서 벤처금융 등 기관투자자가 보유한 4,691,357주(공모 후 33.53%) 및 1% 이상 보유 주주인 Gabmar Vitae LLC, ㈜오상헬스케어,Olympic Funds, LLC가 보유한 1,164,175주(공모 후 8.32%)를 「코스닥시장 상장규정」제26조제1항제7호에 따라 상장 이후 각각 50%씩 분할하여 1개월 및 3개월간 자발적으로 의무보유 기간을 설정하였습니다.
또한, 1% 이상 보유 주주인 방두희 및 ㈜셀레믹스는 상장 이후 경영권 안정 및 투자자 보호 조치 차원에서 총 3년 자발적으로 의무보유를 할 예정입니다. 이에「코스닥시장 상장규정」제26조제1항제7호에 따라 상장일로부터 2년간 한국예탁결제원에 의무보유 후 미래에셋증권㈜ 계좌에서 추가 1년을 의무보유할 예정입니다.
한편, 상장주선인 미래에셋증권㈜는 금번 공모 시 동 규정 제13조제5항제1호나목에 의거 공모주식의 3% 혹은 10억원을 초과하는 경우에서 10억원에 해당하는 수량인 75,000주(공모 후 0.54%)를 확정공모가액과 같은 가격으로 취득하여 상장 후 3개월간 의무보유합니다.
3. 회사의 주요 연혁
| 년도 | 월 | 내용 |
| 2018 | 7 | ㈜아이엠비디엑스 설립(서울시 금천구 가산디지털1로 131, A동 20층) |
| 2019 | 1 | Pre-Series A 투자유치(17억원) |
| 12 | 본점 이전(서울시 금천구 가산디지털1로131, A동 21전층) | |
| 2020 | 1 | KGMP 인증 |
| 4 | Series A 투자유치(80억원) | |
| 6 | 본점 확장 이전(서울시 금천구 가산디지털1로131, A동 21층) | |
| 10 | 김태유 공동 대표이사 선임 | |
| 11 | 알파리퀴드®100(V1) 개발 완료 | |
| 12 | CE-IVD 인증(알파리퀴드®100) | |
| 12 | 가족친화기업 선정(여성가족부장관) | |
| 2021 | 5 | Series B 투자유치(205억원) |
| 6 | 아기유니콘200 기업 선정 | |
| 7 | 본점 확장 이전(서울시 금천구 가산디지털1로131, A동 601-가, 나, 605-가, 나호, 21전층) |
|
| 10 | 알파리퀴드®디텍트 개발 완료 | |
| 12 | 하이서울기업 투자유치부문 표창(서울특별시장 표창) | |
| 2022 | 1 | 알파리퀴드®100(V2) 개발 완료 |
| 3 | 국제 품질경영시스템인증(ISO13485) | |
| 4 | 체외진단의료기기 제조 허가증 수출용(알파리퀴드®100) | |
| 4 | 알파리퀴드®스크리닝 개발 완료 | |
| 11 | 알파리퀴드®디텍트 RUO 출시 | |
| 11 | 영국 아스트라제네카와 전립선암 치료제 동반진단 파트너십 계약체결 | |
| 2023 | 2 | CAP 인증 획득 |
| 3 | 영국 아스트라제네카 전립선암 치료제 동반진단 파트너십 2단계 계약 | |
| 8 | 코스닥 상장 예비심사신청서 제출 | |
| 2024 | 1 | 코스닥 상장 예비심사 승인 |
4. 주주에 관한 사항 (기준일 : 24.02.06)
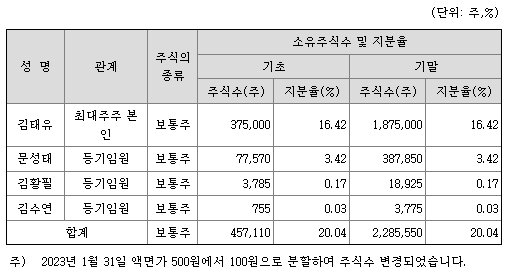
1) 최대주주 및 그 특수관계인의 주식소유 현황
2) 5% 이상 주주의 주식소유현황

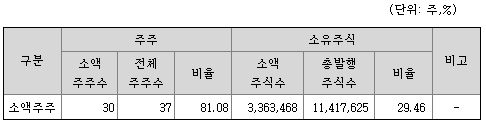
3) 소액주주현황
5. 사업의 내용
1) 사업을 이해하는데 필요한 용어
| 용어 | 해설 |
| AMP/ASCO/CAP 가이드라인 | 서열 변이의 임상 해석을 위해 만들어진 변이 분류 기준: AMP (Association for Molecular Pathology), ASCO (American Society for Clinical Oncology), CAP (College of American Pathologists) 가이드라인 등이 공신력 있는 기준으로 받아들여짐 |
| Base-pair (Bp) | 염기쌍. DNA 염기서열의 길이를 표현할 때 이용되는 기본 단위로도 쓰이며, 약자로 bp 라고 표기 |
| CpG 사이트 (CpG site) | C (시토신)과 G(구아닌)이 인산염으로 연결된 서열 |
| ctDNA 검출한계 | 액체생검 검사에서 검출가능한 ctDNA 분율의 최소수준 |
| DNA (Deoxyribonucleic acid) | 유전자를 이루는 주요 물질로, 네 종류의 뉴클레오티드 염기 (A, C, G, T)의 배열로 이루어짐 |
| DNA 메틸화 (DNA methylation) | C (시토신) 염기의 5번 탄소원자에 메틸화 효소에 의해 메틸기가 화학적 공유결합으로 첨가되는 상태 |
| DNA 염기서열 (DNA Base sequence) |
뉴클레오티드 염기 (A, C, G, T)의 배열 |
| DNA 절편 (DNA Fragment) | DNA 가 잘라진 작은 조각 |
| RNA (Ribonucleic acid) | 유전 정보를 담고있는 DNA로부터 아미노산 정보를 전달하는 고분자 물질로서, 네 종류의 뉴클레오티드 염기인 A (아데닌), G (구아닌), C (시토신), U (우라실)의 배열로 이루어짐 |
| 개인 맞춤형 패널 (Bespoke panel) |
검사 대상 환자의 모든 주요 체세포 변이를 검출하기 위한 목적으로 제작된 패널로, 종양 조직에서 변이가 발견된 유전체의 영역을 타깃 캡처하기 위한 프로브로 구성되어 있음 |
| 검사 소요 시간 (Turn Around Time, TAT) |
검사시행부터 결과가 보고되는 데까지 소요된 시간 |
| 검사실자체개발검사 (Laboratory Developed Test, LDT) | 검사실에서 자체적으로 개발한 검사법을 사용하여 검체를 분석하는 체외진단검사의 한 형태 |
| 결손 (Deletion) | DNA 염기서열에서 하나 이상의 염기가 삭제되는 것 |
| 고유 분자 뎁스 (Unique Molecule Depth) |
검체에 존재하는 독립적인 DNA 분자의 수 |
| 고유 분자 식별자 (Unique Molecular Identifier, UMI) | 독립적인 DNA 분자임을 판단하기 위해 염기서열로 구성된 식별자 |
| 곡선하면적 (Area under the ROC curve, AUC) | 수신자 조작 특성 (ROC) 곡선 아래 부분의 넓이로, 값이 클수록 분류가 잘 된 상태를 뜻함 |
| 균일도 (Uniformity) | DNA 염기서열 당 분자 수의 균일함을 정량적으로 나타낸 값 |
| 뇌척수 (Cerebrospinal fluid, CSF) |
뇌와 척수 및 뇌실을 채우고 있는 액체 |
| 단염기변이 (Single Nucleotide Variation, SNV) | DNA 염기서열 중 하나의 염기가 다른 염기로 대체된 변이 |
| 단일 가닥 합의 시퀀스 (Single Strand Consensus Sequence, SSCS) | 한 개의 DNA 가닥에서 얻어진 일관된 염기 서열 |
| 대용량 시퀀싱 (High-throughput sequencing, HTS) | DNA 또는 RNA 분자의 염기서열을 병렬방식으로 빠르게 분석하는 기술로 대용량의 데이터를 처리할 수 있는 기술 |
| 데이터베이스 (Database, DB) | 여러 사람이 공유하여 사용할 목적으로 정보를 체계화해 통합하고 관리하는 데이터의 집합 |
| 뎁스 (Depth) | 유전체 상의 한 지점에서 리드의 관찰 횟수로 정의되며 뎁스가 클수록 정보량이 많은 것을 의미 (단위는 배수를 의미하는 “X” 로 표현됨) |
| 라이브러리 (Library) | 시퀀스 되어야 할 염기서열들에 어댑터가 부착되어 있는 DNA 조각들의 모음 |
| 리드 (Read) | 차세대염기서열분석 장비가 얻은 정보의 단위체로 라이브러리 염기서열의 일부 |
| 리밸런싱 (Rebalancing) | 캡처 프로브 비율을 조절하여 타깃 영역별로 캡처되는 DNA양을 조절하는 기술 |
| 말초 혈액 단핵 세포 (Peripheral blood mononuclear cells, PBMC) | 말초 혈액에서 존재하는 둥근 핵을 가지는 모든 세포로, 백혈구의 일종이며, 액체생검에서는 혈액암이 아닌 이상, 종양이 아닌 세포로 취급되며 환자의 생식 세포 돌연변이나 클론성 조혈 변이를 제거하는데 이용됨 |
| 매핑 (Mapping) | 차세대염기서열분석으로 생성된 리드들을 참조유전체와 비교하여 각 리드가 유래되었을 것으로 추측되는 위치를 찾아 정렬하는 과정 |
| 미세잔존암 (Minimal residual disease, MRD) | 암의 재발의 원인으로 지목되는 요인으로, 수술 또는 항암 치료 등에 의해 박멸되지 못하고 체내에 남아 있는 아주 작은 암세포 군을 의미함 |
| 민감도 (Sensitivity) | 실제 양성인 사람이 검사를 통해 양성으로 판정되는 비율 |
| 바이오마커 (Biomarker) | DNA, RNA, 또는 단백질 등의 대사 물질을 이용하여 몸 안의 변화를 알아낼 수 있는 지표 |
| 복수 (Ascites) | 단백질이 함유된 액체가 복부 안에 누적된 것 |
| 복제 수 변이 (Copy number Alteration, CNA) | 세포 내의 특정 유전자의 DNA 복제본의 개수가 정상보다 적거나 많은 것 |
| 삽입 (Insertion) | DNA 염기서열에서 특정 뉴클레오티드나 일부분이 추가되는 돌연변이 |
| 삽입결손 (Insertion or deletion, INDEL) | 삽입과 결손의 합성어로 DNA 염기서열에서 작은 길이(1~100bp)의 염기가 삽입되거나 결손되는 돌연변이를 의미함 |
| 상동 재조합 결핍 (Homologous Recombination Deficiency, HRD) | DNA 손상을 복구하는 HRR 메커니즘이 제대로 작동하지 않아 발생하는 상태 |
| 상동재조합복구 (Homologous Recombination Repair, HRR) | DNA 이중고리의 교차점을 해체하거나, SNV 증의 DNA 손상을 복구하는 데 사용되는 DNA 수리 메커니즘 |
| 생식세포 돌연변이 (Germline variant) | 부모에게서 물려받은 유전체상의 변이로, 개인의 외형 등을 구분 짓는 변이임 |
| 생어염기서열분석 (Sanger sequencing) | DNA 시퀀싱의 한 방법으로, 형광 표지된 디옥시뉴클레오티드 종결자와 모세관 전기영동을 사용하여 DNA의 뉴클레오티드 서열을 결정하는 방법 |
| 세포 유리 DNA (cell-free DNA, cfDNA) | 다양한 원인에 의해 세포가 사멸되면서 체액으로 방출되는 DNA로, 아이엠비디엑스가 보유한 모든 기술의 검사 대상이 되는 시료임 |
| 세포자연사 (Apoptosis) | 다세포 생물에서 발생하는 계획적으로 세포가 죽는 과정 |
| 수신자 조작 특성 (Receiver Operating Characteristics, ROC) | 민감도와 특이도로 그려지는 곡선으로 분류 모델의 성능을 표현하는 커브로, 좋은 모델일수록 좌측상단으로 치우치는 경향이 있음 |
| 순환 종양 DNA (circulating tumor DNA, ctDNA) | 종양 세포가 다양한 이유로 사멸하면서 체액으로 방출되는 DNA로 세포 유리 DNA를 추출했을 때 일부분으로 존재함 |
| 승객 돌연변이 (Passenger mutation) | 암의 초기에 발생하는 운반 돌연변이의 반대 개념으로, 암의 형질에는 영향을 주지 않지만 클론성 확장 과정에 항상 존재함 |
| 시발체(primer) | DNA 합성의 기시점이 되는 짧은 유전자 서열로, 중합효소 연쇄 반응법이나 DNA 시퀀싱 등에 이용할 목적으로 합성됨. |
| 앙상블 모델링 (ensemble modeling) | 여러 개의 분류기/모델을 생성하고, 그 예측을 결합함으로써 보다 정확한 예측을 도출하는 기법 |
| 액체생검 (Liquid biopsy) | 종양 조직이나 종양세포에서 유리된 DNA, RNA, 단백질 등 종양 마커들을 혈액, 요, 체액 등에서 검출하는 기술 |
| 앰플리콘 (Amplicon) | PCR과 같은 DNA 증폭 기술을 사용하여 생산된 DNA 조각 |
| 양성예측도 (Positive predictive value, PPV) | 검사를 통해 양성 판정을 받은 사람이 실제로 양성인 비율 |
| 어댑터 (Adaptor) | 시퀀서에서 인식할 수 있도록 사전에 설계한 특정 염기서열을 가진 올리고뉴클레오티드 |
| 염기 (Base) | DNA 구성 성분으로 A (아데닌), G (구아닌), C (시토신), T (티민) 네 가지 종류가 있음 |
| 운반 돌연변이 (Driver mutation) |
유전체에 발생한 체세포 돌연변이 중 획득 시 종양 세포로 변화시키는 돌연변이 |
| 원발암 (Primary cancer) | 암이 처음 시작한 장기의 암 |
| 위양성 (False positive) | 실제로는 음성이나 실험에서 얻은 결과가 양성으로 나타나는 경우 |
| 위음성 (False negative) | 실제로는 양성이나 실험에서 얻은 결과가 음성으로 나타나는 경우 |
| 유전체 (게놈, Genome) | 한 개체에 존재하는 모든 유전자와 유전적 정보를 포함하는 총 염기서열 |
| 융합 (Fusion) | 둘 이상의 유전자가 복합체를 형성하여 새로운 단백질을 생성하는 과정 |
| 의료기기제조및품질관리기준 (Good Manufacturing Practice, GMP) | 의료기기의 안전성과 유효성을 확보하기 위해 준수해야 하는 우수 의료기기의 제조 및 관리 기준 |
| 이중 합의 시퀀스 (Duplex Consensus Sequence, DCS) | 같은 DNA 분자에서 양쪽 가닥의 염기서열을 동시에 분석하여 일관된 염기서열을 갖는 경우 |
| 인간참조서열 (Human reference sequence) | 인간을 대표하는 1인의 가상 염기서열. 변이 판정의 기준이 되어야 하므로 높은 품질로 만들어진 인간 염기서열의 뼈대를 이루는 합성유전체 |
| 전사체 (Transcriptome) | 유전자들이 전사되어 만들어진 모든 RNA의 집합 |
| 전장 엑솜 시퀀싱 (Whole Exome Sequencing, WES) | 인간 유전체를 구성하는 영역 중 유전자의 기능을 결정하는 전 영역(엑솜)에 해당하는 DNA를 하이브리드 캡처를 통해 선별하여 차세대염기서열분석법으로 해독하는 방법 |
| 전장 유전체 메틸레이션 시퀀싱(whole genome methylation sequencing, WGMS) | DNA 메틸화 상태를 볼 수 있도록 실험기법을 적용한 후 사람의 염기서열 전체를 차세대염기서열분석법으로 생성하는 시퀀싱 기법 |
| 전장유전체 시퀀싱 (Whole Genome Sequencing, WGS) | 사람의 염기서열 전체를 차세대염기서열분석법으로 해독하는 방법 |
| 전혈 (Whole blood) | 적혈구와 백혈구, 혈장, 혈소판 등 혈액의 전체 성분 |
| 절편화 (Fragmentation) | DNA가 조각으로 잘리는 과정 |
| 정밀의료 (Precision medicine) | 개인의 환경, 유전, 생물학적 특성을 고려하여 진단과 치료를 맞춤화하는 의료 접근 방법 |
| 조직생검 (Tissue biopsy) | 암 환자의 조직의 일부를 채취하여 병리학자가 현미경 등을 통해 암을 확진하는 방법 |
| 종양 돌연변이 빈도 (Variant allele frequency, VAF) | 종양의 체세포 돌연변이를 가지는 DNA의 빈도로, 조직에서는 5%~수십% 수준으로 분포하지만 ctDNA의 검출에서는 이 값이 통상적으로 0.0001%~1% 이하로 낮은 영역에서 분포함 |
| 종양 이질성 (Tumor heterogeneity) | 서로 다른 환자에서 동일한 유형의 종양 간의 차이, 단일 종양 내의 암세포 간의 차이 또는 원발성(원래) 종양과 이차성 종양 간의 차이를 설명하는 용어 |
| 종양변이부담 (Tumor Mutation Burden, TMB) | 종양 내에서 발생한 돌연변이의 빈도수를 나타내는 지표 |
| 종양표지자 | 종양이 있을 때 종양 자체에서 또는 인체의 반응으로 생성되는 물질로 정상 조직과 구별하기 위해서 또는 종양이 존재하는 것을 결정하기 위해서 혈액 또는 체액에서 측정할 수 있는 물질 |
| 중합효소 연쇄 반응법 (Polymerase Chain Reaction, PCR) | DNA 또는 RNA의 특정 영역을 시험관 내에서 증폭하는 기술 |
| 차세대염기서열분석법 (Next Generation Sequencing, NGS) | 하나의 유전체를 무수히 많은 조각으로 분해하여 각 조각의 서열 정보를 초 병렬적으로 동시에 읽어내어 유전체를 분석하는 기술 |
| 체세포 돌연변이 (Somatic variant) | 종양 유전체에서 발생하는 돌연변이의 일종으로, 부모에게서 물려받은 것이 아닌 살아가는 과정에서 얻어진 돌연변이임 |
| 초고뎁스 시퀀싱 (Ultra high depth sequencing) | 시퀀싱 뎁스를 크게 증가시켜 대량으로 생산된 데이터를 바탕으로 매우 낮은 VAF를 가지는 ctDNA를 검출하기 위해 이용하는 방법으로, 통상적으로 100,000x 수준 이상의 시퀀싱을 의미함 |
| 클론성 조혈 변이 (Clonal hematopoiesis of indeterminate potential variant, CHIP variant) | 인간의 노화에 따라 조혈모세포에 축적되는 돌연변이로, 생식세포 돌연변이가 아니기 때문에 마치 종양 변이로 검사되어 액체생검에서 나타나는 위양성 원인 중 하나 |
| 타깃 캡처 (Target capture) | 유전체에서 검사의 대상이 되는 영역에 속한 DNA만을 선별하는 기술 |
| 타깃 패널 시퀀싱 (Targeted panel sequencing) | 차세대염기서열분석법을 수행하기 위한 전처리 과정에서 타깃 캡처를 포함하는 방법 |
| 특이도 (Specificity) | 실제 음성인 사람이 검사를 통해 음성으로 판정되는 비율 |
| 패널 (Panel) | 표적 유전자나 유전자 집합체를 대상으로 분석하는 기술이나 방법 |
| 패밀리 크기 (Family size) | 하나의 합의 시퀀스를 구성하는 리드의 개수 |
| 폐세척액(Bronchoalveolar lavage, BAL fluid) | 기관지내시경을 통해 종양이 위치한 부위에 접근해 식염수로 세척하여 얻은 액 |
| 표적치료 (Targeted therapy) | 종양 세포 내에 존재하는 특정 유전자, 단백질 또는 기타 분자를 공격하거나 억제하여 종양세포를 파괴하거나 성장을 억제하는 약물 치료 방법 |
| 품질관리 (Quality control, QC) | 제품품질의 유지와 향상을 기하기 위한 관리 |
| 프로브 (Probe) | 유전체의 검사 대상이 되는 영역의 DNA를 선별적으로 솎아내기 위해 제작되는 시약으로, DNA 또는 RNA로 구성됨 |
| 플로우셀 (Flowcell) | 일루미나 차세대염기서열분석 장비에 들어가는 키트 |
| 하이브리드 캡처 (Hybrid capture) | 타깃 캡처 기술로 프로브를 이용하여 유전체에서 검사 대상 영역에 속한 DNA만을 선별하는 실험 기법 |
| 핫스팟 (Hotspot) | 종양 유전체 돌연변이 중에서, 암 환자에서 공통적으로 발견되는 운반 돌연변이 |
| 핵산 (Nucleic acid) | 유전 정보를 저장하고 전달하는 생물학적 분자. DNA 와 RNA의 두 가지 유형으로 나누어짐. |
| 현미부수체 불안정성 (Microsatellite Instability, MSI) | 유전자의 DNA 내에 있는 단일 염기 반복 단위인 현미부수체(microsatellite)의 길이 변화 |
| 혼성화 (Hybridization) | 프로브가 대상 DNA와 결합하는 과정 |
| 후성유전체 (Epigenome) | 유전체 상의 자체 조절이나 노화 및 환경에 의해 변화되는 서열 정보들의 총합 |
| 흉수 (Plural effusion) | 흉막강(호흡할 때 움직임이 원할하도록 폐를 싸고 있는 막 내의 공간)에 비정상적으로 고인 액체 |
2) 사업의 개요
아이엠비디엑스는 혁신적인 액체생검 기술에 기반하여 암발생 전주기에 걸쳐 환자 맞춤형 정밀의료 및 조기진단을 가능하게 함으로써 암정복에 도전하는 글로벌 헬스케어 기업입니다. 아이엠비디엑스의 주요 사업분야는 진행암의 정밀진단 및 치료, 수술 후 재발 조기탐지, 그리고 암 조기진단 등의 3가지로 구성됩니다.
암은 2040년에는 2,800만명이 발생하고 1,620만명이 사망할 것으로 예상되는 등 인류건강의 최대 위협이 되고 있습니다. 국내의 경우도 암은 전체 한국인 사망의 약 26%을 차지하며, 사망 원인 1위입니다. 그러나 다행히 1970년도 이후 지속적으로 증가하던 암에 의한 사망률은 2000년 이후부터 서서히 감소하기 시작하여 1990년 대비 15% 감소하였으며, 이는 수술, 방사선, 항암치료 등 기존 암치료기술 이외에 맞춤표적치료의 개발과 암 스크리닝 등 정밀의료의 확산이 큰 기여를 한 것으로 평가되고 있습니다.
암 정밀의료의 핵심은 조직생검(solid biopsy)을 통해 보다 정밀하게 암세포의 유전자변이를 분석하고 다양한 스크리닝 검사를 통해 최대한 조기에 암을 탐지하는 것입니다. 하지만 2013년 액체생검(liquid biopsy) 기술이 개발되면서, 암 정밀의료의 새로운 패러다임이 만들어지고 있습니다. 조직생검은 환자에게서 종양이 의심되는 조직을 직접 떼어내어 검사하는 방법이지만, 액체생검은 혈액, 소변, 흉수, 뇌척수 등과 같은 체액 내 부유하는 세포 유리 DNA(cell-free DNA, cfDNA)를 이용하여 암 조직에서 유래한 순환 종양 DNA(circulating tumor DNA, ctDNA)를 발견하고 종양 성분을 검출함으로써 암을 진단하는 방법입니다.

조직생검은 조직을 직접 검사함으로써 확실한 진단을 제공하는 검사방법이지만 환자의 의료비 부담을 가중시키고, 외과적 시술이 필요하기 때문에 흉터가 남으며, 조직의 위치나 암의 진행 상태에 따라 검사가 어려운 경우도 있고, 출혈, 통증, 감염 등의 부작용이 발생할 수 있습니다. 또한, 종양으로 의심되는 특정 부위만 조직을 채취하기 때문에 같은 종양의 다른 부위에서 나타나는 유전적 이질성(intra-tumoral heterogeneity)이나, 전이된 종양의 이질성(inter-metastatic heterogeneity) 때문에 종양에 대한 정보가 제한적일 수밖에 없습니다. 이러한 기존 조직생검의 한계를 극복하고 정밀의료를 구현하고자, 쉽게 얻을 수 있는 체액을 이용하여 종양 성분을 검출하고 암을 진단하는 액체생검 기술에 대한 관심이 높아지고 있습니다.

액체생검은 최소침습적 방법으로 조직검사에 비해 부작용이 적고 저비용으로 단시간 내에 검사가 가능한 장점이 있습니다. 암의 조기 발견적 측면에서도 세포유리 DNA(cfDNA) 내에서 미세한 순환 종양 DNA(circulating tumor DNA, ctDNA)를 발견할 수 있는 액체생검은 그 중요성이 매우 크다고 할 수 있습니다. 암진단을 위한 기존의 검사법인 CT, MRI 등 영상검사와 내시경검사는 종양이 일정크기(>1cm) 이상에서만 탐지가 가능한 반면에, ctDNA 액체생검은 1cm 이하의 작은 종양에서도 혈액으로 배출되는 극미량의 유전자를 탐지할 수 있는 첨단 정밀의료 기술이기 때문입니다. 하지만, 혈액 내에 존재하는 극미량의 암유전자를 검출해야 하기에 관련 기술의 고도화가 요구됩니다.
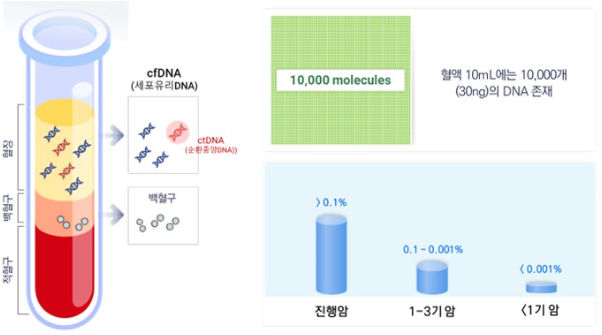
ctDNA는 종양이 성장하면서 세포자연사(apoptosis) 등 다양한 기전을 통하여 혈액 등으로 배출된 세포내부의 유전자입니다. 혈액 내 존재하는 ctDNA의 양은 일반적으로 종양의 병기에 따라 다르게 나타나며, 암 병기별로 액체생검 기술의 난이도와 임상응용 분야가 세분화됩니다. 3-4기 진행암의 경우 0.1% 이상의 ctDNA를 탐지하는 기술을 활용하며 이는 표적치료제를 위한 동반진단 및 치료내성 유전변이 발굴 등에 적용되고 있습니다. 1~3기 암의 수술 이후 미세잔존암을 추적하는 재발 조기진단 분야는 0.001~0.1%의 ctDNA를 탐지할 수 있는 기술을 필요로 합니다. 또한 암을 조기 진단하기 위해서는 유전자 변이에 비해 비교적 암 발생 초기에 발생하여 더 많은 암세포에서 유지되는 것으로 알려진 메틸레이션 변화를 확인해야 할 뿐만 아니라, 0.001% 미만의 ctDNA를 탐지하는 고도화된 검출기술과 전략이 필요합니다.
아이엠비디엑스는 차별화된 기술력으로 액체생검과 대량의 유전자의 염기서열을 분석할 수 있는 차세대염기서열분석을 접목시켜 (i) 진행암 환자 대상의 프로파일링 기술, (ii) 1-3기암 수술 후 재발 조기진단을 위한 디텍트 기술, (iii) 암을 조기에 발견하고 원발부위를 예측하는 스크리닝 기술 등 암 전주기에 적용할 수 있는 모든 기술을 확보하였고 상용화 가능한 제품을 만들었습니다.
액체생검과 차세대염기서열분석법(next-generation sequencing, NGS)의 개요와 아이엠비디엑스 기술력의 특장점을 간략하게 설명하면 다음과 같습니다.
▣ 유전자 염기서열 변이에 의한 암의 발생
우리 몸의 유전자(DNA)는 A, T, G, C의 4 가지 ‘염기’로 구성되어 있으며, 세포 하나당 총 30억개의 염기가 길게 연결된 형태로 존재합니다. 외부적 자극, 술, 담배, 노화 등 다양한 원인에 의해서 세포내의 유전자 염기서열이 조금씩 바뀌게 되는데, 이러한 변이가 세포의 성장과 사멸에 중요한 유전자에 우연히 생기고 이것이 오랜 시간 누적되면 암으로 발전하게 됩니다. 이러한 특성을 이용하여, 우리 몸을 구성하는 세포의 유전자 염기서열을 검사하여 정상과 다른 유전자 돌연변이가 발견될 경우 암세포가 존재함을 확인할 수 있습니다.
▣ 순환종양유전자 (circulating tumor DNA, ctDNA)와 액체생검
우리 몸을 구성하는 각각의 세포들은 살아가는 동안 지속적으로 성장과 사멸(죽음)을 반복하게 되고, 이때 사멸된 세포내에 존재하던 유전자(DNA)의 조각들이 혈액 속을 떠나니게 되는데, 이를 세포유리유전자(cell-free DNA, cfDNA)라고 합니다. 만약 우리 몸에 암세포가 존재한다면, 정상세포와 마찬가지로 암세포도 성장과 사멸을 반복하면서 역시 그 조각들을 혈액 속에 남기게 되며, 이를 순환종양유전자(ctDNA)라고 합니다.
정상세포에서 기원한 세포유리유전자에 비해 순환종양유전자는 유전적 돌연변이를 갖고 있으며 유전자 조각의 길이도 상대적으로 짧으며, 암의 진행에 따라 유전자의 발현을 조절하는 서열의 변화도 반영하고 있음을 최근 연구 결과 밝혀냈습니다. 정상유전자와 순환종양유전자의 이와 같은 차이를 이용하여 외과적 수술 없이 혈액 속에 떠다니는 유전자를 검사하는 것 만으로도 암세포 존재여부를 확인할 수 있는 진단 방법이 새로이 개발되었으며, 이를 액체생검이라 합니다.
▣ 혈액에서 추출된 세포유리유전자(cfDNA)
10mL의 혈액에 Ficoll이라는 약품을 섞어서 원심분리(혼합물을 전용 튜브에 넣고 빠른 속도로 회전시켜 물질을 서로 다른 정도로 침전시키는 방법)를 진행하면, 혈액속에 존재하는 각종 혈액세포와 다양한 혈액구성물질들이 비중차이에 의해서 분리되며, 이를 이용하여 상대적으로 가벼운 혈장 성분만을 추출할 수 있습니다. 이 혈장 성분 내에 세포유리유전자가 존재하며, 유전자와 쉽게 결합하는 특징을 갖는 구슬(glass beads)을 이용하여 혈장성분 중에서 세포유리유전자만 분리할 수 있습니다.
▣ 차세대염기서열분석법(next-generation sequencing, NGS)을 이용한 대량의 염기서열 검사
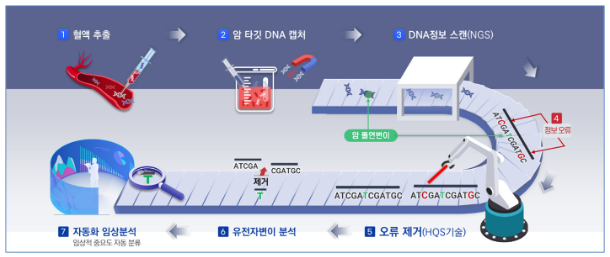
최근 개발된 차세대염기서열분석법(NGS)은 분석하고자 하는 전체 유전자를 잘게 자른 후에 어댑터(adapter) 라고 불리는 물질을 붙여 줌으로써 조각난 각각의 유전자 염기서열을 동시에 확인할 수 있는 분석법입니다. 기존의 한조각 한조각씩 읽어 나가는 전통적인 생어(Sanger) 염기서열 분석법에 비해서 상대적으로 가격이 저렴하며 빠른 시간 내에 유전자 수백만 개의 염기서열을 분석할 수 있는 매우 획기적인 검사 방식이기에 ‘차세대(Next generation)’염기서열분석법이라 부르게 되었습니다. 차세대염기서열분석법을 이용한 유전정보 분석은 다음과 같은 단계를 통해서 진행됩니다.
(i) 라이브러리 준비 : 분석 대상 유전자를 검사하기 위해 DNA를 물리적, 생화학적 방법을 통해 짧은 길이로 절편화 하고 NGS 장비를 통해 분석할 수 있도록 어댑터를 부착합니다. 실험을 통해 얻어지는 DNA의 양은 매우 적으므로 중합효소연쇄반응(PCR)을 통해 충분한 양의 라이브러리를 만든 후에 NGS 분석 장비에 탑재합니다.
(ii) NGS 분석 장비를 통해 라이브러리 증폭 후 서열 판독(시퀀싱) : NGS 분석 장비에는 플로우 셀이라고 불리는 기판이 존재하며 플로우 셀의 표면은 어댑터를 인식하여 기판에 고정시키도록 처리되어 있습니다. 기판에 고정된 라이브러리를 구성하는 각각의 DNA 분자가 장비 내부에서 PCR을 통해 동일한 DNA 서열로 구성된 클러스터로 증폭되고, 클러스터를 구성하는 각각의 DNA 서열은 A, C, G, T의 염기서열로 판독(시퀀싱) 됩니다. 이 염기서열을 정보의 단위체인 ‘리드’라고 합니다.
(iii) 바이오인포매틱스 분석 : 시퀀싱을 통해 얻어진 데이터(시퀀싱 데이터)는 단순 염기서열의 기록일 뿐이므로 그 자체로는 의미가 없습니다. 시퀀싱 데이터를 분석하여 유전체 정보를 해독하고 의미를 찾는 일련의 과정을 바이오인포매틱스 분석이라고 하며 현대의 유전체학 및 정밀의료의 핵심입니다. 따라서 시퀀싱 데이터를 인간참조서열(human reference sequence)과 비교하는 과정을 통해 각 DNA 염기서열(리드)이 유래했을 것으로 예측되는 게놈 상의 위치를 찾아 정렬하는 매핑(mapping)을 진행합니다. 매핑을 하고나면, 인간의 보통 유전자서열과 다른 부분들을 파악할 수 있고, 이를 이용하여 생식세포 돌연변이, 체세포(암유래) 돌연변이, 암유래 메틸화 변화, 등 여러 유전체 형질에서의 특이점들을 파악할 수 있게 됩니다.
▣ 순환종양유전자 분석에 있어 NGS가 지니는 한계
차세대염기서열분석법을 정밀한 바이오인포매틱스 분석기술과 결합하면, 분석되는 샘플의 유전자 특징을 매우 빠르게 염기단위로 파악하여, 암 진단 또는 유전자 돌연변이 종류에 따라 효과적인 항암제 제시 등, 환자마다 서로 다른 치료방법을 제시하는 이른바 ‘개인맞춤형 치료’ 방법에 적용할 수 있습니다.
하지만, 혈액 10mL에서 얻을 수 있는 세포유리유전자의 양은 10~50ng 정도로 매우 적은 양입니다. 또한, 이중 암세포에서 기원한 순환종양유전자는 전체 세포유리유전자의 0.1~0.001% 정도로 매우 적습니다. 따라서 세포유리유전자 내에 극소량으로 존재하는 순환종양유전자를 구별하기 위해 최신 기술의 차세대염기서열분석 방법을 이용하더라도 실험 및 분석 진행과정 동안 어느정도 오류 (0.087%)가 생길 수밖에 없으며 이로 인해 실제 유전자 돌연변이가 없음에도 불구하고 돌연변이가 있다는 잘못된 결과값을 생성할 수 있습니다.
시퀀싱 오류를 실제 돌연변이와 구분하기 위해서는 많은 양의 리드, 즉 높은 시퀀싱 뎁스(유전체 상의 한 지점에서 관찰되는 리드의 횟수)가 요구됩니다. 예를 들어 혈액 내 0.1%의 ctDNA를 발견하기 위해서는, 1,000개의 cfDNA 조각 중, 1개의 ctDNA 조각을 찾아내는 정확도가 필요합니다. NGS 시퀀싱 데이터는 PCR 증폭과정을 거쳐 생성되는 DNA 염기서열(리드)들로 구성되어 있으므로, 일반적으로 1,000개의 독립된(고유) DNA 분자에서 한 개의 변이 차이를 정확하게 찾아내기 위해서는 그보다 수배 또는 수십배의 시퀀싱 뎁스가 요구됩니다.
▣ 순환종양유전자의 분석적 한계 극복을 위한 아이엠비디엑스의 전략
혈액 내 순환종양유전자의 비율은 매우 소량이기 때문에 일반적인 차세대염기서열분석법 보다 100~1,000배 많은 시퀀싱을 해야 합니다. 고용량 시퀀싱에 따른 비용부담을 줄이기 위해, 아이엠비디엑스는 전체 2만여 개 유전자 중 핵심적인 암 관련 유전자만 선별하여 검사하는 하이브리드 캡처(Hybridization capture) 방법을 선택했습니다. 또한, 고유 분자 식별자(Unique molecular identifier, UMI) 기술을 도입하여 차세대염기서열분석을 위한 증폭과정동안 생기는 오류를 보정함으로써, 실험 및 분석과정에서 발생하는 오류와 환자의 암세포에서 기원한 돌연변이를 정확히 구별할 수 있게 하였습니다.
6. 주요 제품 및 서비스
1) 주요 제품
가) 알파리퀴드®100, 알파리퀴드® HRR : 진행암 정밀진단/치료를 위한 프로파일링 제품
아이엠비디엑스는 액체생검 프로파일링 기술을 이용하여 모든 종류의 암 진행을 정밀진단 할 수 있는 알파리퀴드®100과 표적치료제 동반진단용 알파리퀴드®HRR을 개발하였습니다. 알파리퀴드®100은 암 관련 주요 유전자 118개의 유전자변이 여부를 분석할 수 있는 하이브리드 캡처 기반의 NGS 패널로서, 혈액 10mL를 이용하여 종양으로부터 기원한 유전자변이를 분석하여 맞춤 표적치료제를 선별하고, 치료효과 모니터링, 항암제 내성 유전자변이 발굴 등에 활용되고 있습니다. 혈액 이외에도 흉수, 소변, 뇌척수액, 폐세척액 등 다양한 체내 액체 검체에 대한 유전자변이 검사에도 이용하고 있습니다. 알파리퀴드®HRR은 118개의 유전자중 15개의 상동재조합복구(homologous recombination repair, HRR) 유전자만을 선별하여 검사하는 상동재조합복구 관련 표적치료제의 동반진단 용으로 개발되었습니다.
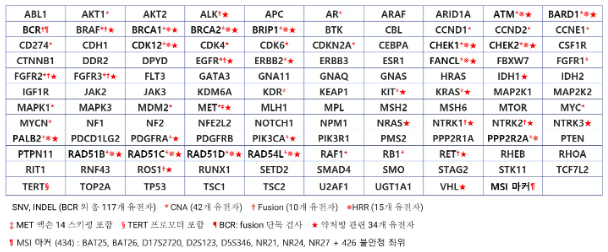
두 검사의 핵심기술은 혈액 내 존재하는 극미량의 ctDNA를 정확히 탐지하는 것으로서, 고성능 타깃 캡처 기술, 오류 최소화 high quality sequence(HQS) 알고리즘 기술, 액체생검 최적화 변이 분석 알고리즘 기술, 자동화 임상분석 기술 등 4대 세부기술을 기반으로 프로파일링 기술의 타깃목표인 ctDNA 0.1% 검출 한계를 달성하고 조직일치도 97.6%로서 조직생검을 대체할 수 있는 성능을 갖고 있습니다.
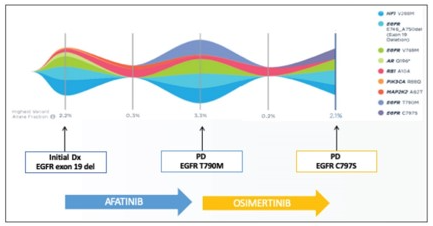

나) 캔서디텍트 : 수술 후 재발 조기탐지를 위한 디텍트 제품
1-3기 암으로 수술받은 환자의 평균 30%는 재발하여 사망하게 되므로 수술 후 암재발을 조기에 진단하는 것은 생존율을 개선하는데 필수적입니다. 암 재발은 수술 당시 남아있는 미세잔존암에 의한 것으로 기존의 CT 등 영상 검사 등으로는 탐지가 어렵습니다. 특히, 진행암의 경우 혈액에서의 ctDNA 비율이 0.1% 이상 검출되지만, 미세잔존암은 1기보다 암세포 수가 훨씬 적어서 0.01% 이하의 고도화된 탐지 기술이 요구됩니다. 아이엠비디엑스의 캔서디텍트는 수술 후 남아있는 초 극미량의 ctDNA를 탐지하는 제품으로서 국내 최초로 개발되었고, 전 세계적으로도 조직 유래 캡처 기반 패널로는 세 번째로 개발된 제품입니다.
캔서디텍트는 먼저 환자 암조직의 유전자변이를 선별하여 개인 맞춤형 혈액진단용 패널을 만들고, 수술 후 환자의 혈액을 이용하여 재발 여부를 탐지하게 됩니다. 현재 전 세계 최초로 개발된 미국 시그나테라TM(SignateraTM) 제품은 조직유래 중합효소 연쇄 반응법(polymerase chain reaction, PCR) 기반 제품으로 16개의 유전자변이 만을 검사하고 ctDNA 검출한계는 0.01 % 인 반면, 아이엠비디엑스가 개발한 디텍트 기술은 종양 유전체 변이 정보 기반 개인 맞춤형 패널 검사, 최대 500개의 모니터링 변이 추적 관찰 기술, ctDNA의 절편을 효율적으로 증대하는 기술, 저항성 돌연변이를 가지는 암세포의 발생 검사 기술 등 4대 세부기술을 기반으로 하여 0.001% 까지의 ctDNA 검출이 가능하다는 장점이 있습니다.
캔서디텍트는 국책과제인 대장암 정밀과제에 도입하여 2~3기 대장암 환자를 대상으로 전향적 연구를 수행한 결과, 수술 1개월 후 디텍트 검사 양성인 환자는 음성에 비해 재발 가능성이 8배 높음을 확인하였으며, 디텍트 검사 결과에 따라 재발 방지를 위한 항암치료를 결정하는 임상적 유용성을 갖고 있음을 2022년 8월 입증한 바 있습니다.

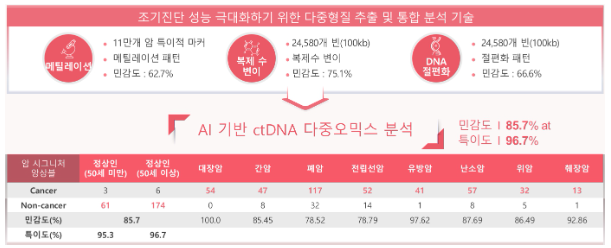
다) 캔서파인드 : 다중암 조기진단을 위한 스크리닝 제품
암 조기진단은 사망률 감소와 생존율 증가에 가장 크게 기여하고 있으며 전 세계적으로 보다 효과적인 조기진단 기술을 개발하기 위한 연구가 활발히 진행중입니다. 증상이 없는 초기 암의 경우 크기가 매우 작기 때문에 영상검사 혹은 내시경검사로 발견이 어려우며, 혈액 암표지자 검사 역시 낮은 민감도와 특이도로 사용에 제한이 있는 상황입니다.
아이엠비디엑스가 개발한 캔서파인드는 혈액 내 0.001% 미만으로 존재하는 ctDNA의 후성유전체 특성을 분석하여 암 특이적 메틸레이션 패턴을 탐지 가능합니다. 아울러 어떤 장기로부터 유래되었는지에 대한 정보까지 확인할 수 있기 때문에, 10mL 채혈로 다중암(multi-cancer) 조기진단이 가능한 혁신적인 혈액기반 다중암 조기진단 제품입니다. 아이엠비디엑스의 캔서파인드는 암 메틸레이션 패턴 탐지 기술, 복제수 변이 데이터 가공 및 암 특이적인 패턴 선별 기술, DNA 절편화 데이터 가공 및 암 특이적인 패턴 선별 기술, 암 유전체 특징 통합 분석 기술 등 4대 세부기술을 적용하여 개발된 제품으로서 정상인과 8개 암종의 암환자 약 2,000여명에 대한 임상 검증을 수행하여 10mL의 적은 양의 혈액으로 96.7% 특이도에 85.7%의 민감도를 기록했고, 약 83%에서 암 발생부위를 정확하게 예측하는 성능을 보였습니다.
7. 매출 및 수주상황
액체생검은 암 생애 전 주기에 적용 가능한 진단 기술로, 적용대상 환자 및 활용 분야에 따라 크게 3가지 목표시장을 두고 있습니다.
① 암 진단/치료 시장 : 액체생검을 통해 3-4기 진행암 환자를 대상으로 종양 관련 유전자 변이를 확인하고 치료제 선별을 위한 동반진단과 치료반응 모니터링에 활용될 수 있습니다. 아이엠비디엑스는 이를 위하여 프로파일링 핵심기술을 기반으로 한 알파리퀴드®100과 알파리퀴드®HRR 제품을 보유하고 있습니다.
② 수술 후 재발 모니터링 시장 : 1-3기 암환자의 수술 후 미세잔존암을 탐지하여 재발을 조기에 발견함으로써 생존기간을 높이는 목적으로 액체생검을 활용할 수 있습니다. 아이엠비디엑스는 이를 위하여 핵심기술을 기반으로 한 알파리퀴드®디텍트 제품을 보유하고 있습니다.
③ 암 검진 시장 : 일반인 및 암고위험군을 대상으로 하는 스크리닝 목적으로 액체생검을 이용해 암을 조기에 진단하는 검사로 사용될 수 있습니다. 아이엠비디엑스는 스크리닝 핵심기술을 기반으로 한 알파리퀴드®스크리닝 제품을 보유하고 있습니다.
아이엠비디엑스는 국내 4.8조원, 글로벌 98조원 수준의 잠재 시장이 존재한다고 추정하고 있으며 특히, 디텍트와 스크리닝 기술제품의 시장 규모가 향후 몇 년간 빠르게 성장할 것으로 예측됩니다.

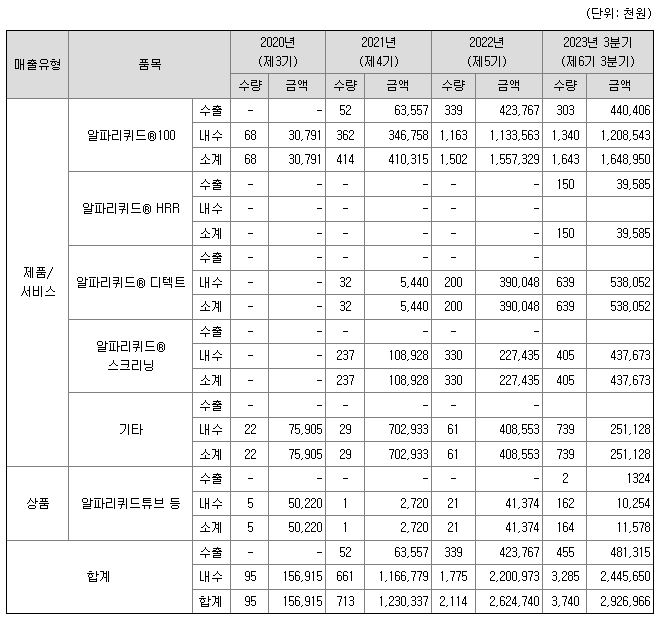
1) 매출실적
아이엠비디엑스의 2020년~최근3분기말 매출개요는 알파리퀴드®100 제품을 필두로 신규 제품이 해마다 추가되면서 매출도 증가하는 추세입니다. (매출의 3분기 평균 성장률을 계산하면 149% 수준입니다.)
제품이 개발된 후 국내 임상 적용, 국내 연구자와의 연구 등으로 대부분의 매출이 발생하고 있는 상황이며, 해외 매출도 2021년부터 발생하여 빠른 속도로 성장 중입니다.
2) 주요매출처
매출처가 가장 다양한 알파리퀴드®100 제품은 30여 개소의 종합병원과 연구기관에서 활용되고 있으며 글로벌 제약사 아스트라제네카는 아시아, 남미, 유럽 대륙 11개 국가의 아스트라제네카 지사를 통해 아이엠비디엑스의 알파리퀴드®HRR 제품을 판매하고 있습니다.
향후 상급종합병원, 수탁검사 전문기관, 대학의 주요 연구자 대상 서비스 매출 뿐 아니라, 글로벌 제약사와의 협업, 바이오 제약사의 신약 개발 과정에서의 평가 검사로 판로를 확대하여 매출처를 더욱 다변화 할 예정입니다.

3) 수출 현황
2021년 대만 시장 진입에 성공한 이래 매년 수출국이 다양해지고 있습니다. 최근 3분기말 기준 6개 국가에서 매출이 발생하고 있습니다.

4) 수주 현황

8. 원재료 및 생산설비
1) 원재료 매입현황
아이엠비디엑스의 매입유형은 원재료와 상품으로 구분할 수 있습니다. 원재료는 제작키트, 프로브(패널), 효소/시약, Flowcell 및 기타로 구분됩니다. 생산방식의 변화로 2021년도 이후부터는 효소/시약을 사용하지 않고 있습니다.

2) 원재료 가격변동추이
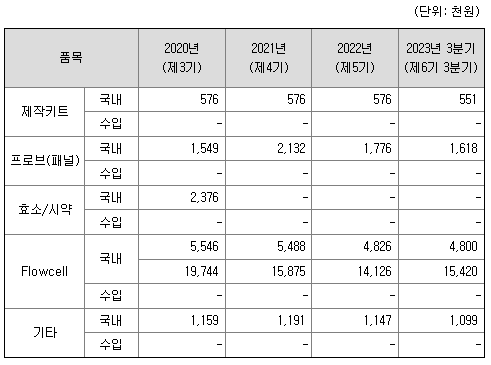
3 사업년도 동안의 원재료 가격변동추이를 비교하기 위하여, 원재료를 구성하는 각 품목별로 지속적으로 매입한 제품을 골라 년도별 가격을 기록하였습니다.
프로브(패널)를 제작하는 여러 업체들 중 아이엠비디엑스가 원하는 수준의 품질과 가격을 제시하는 업체를 대상으로 원재료 납품을 받고 있습니다. 그 외의 원재료를 구성하는 품목들은 글로벌 외국계 회사가 제작하는 제품이지만, 대부분 국내에 자사 및 직영 대리점을 운영하여 가격 및 재고 수급을 안정적으로 유지하고 있습니다. 또한, 대부분의 품목들은 동급 및 동가격대의 타 회사 제품으로 변환을 하여도 아이엠비디엑스의 제품생산 및 서비스에 큰 변화가 없음을 확인하여, 이를 바탕으로 공급가격 및 재고 수급에 크게 문제가 없는 방향으로 매입을 진행하고 있습니다.
가장 높은 비중과 가격이 높은 원재료는 NGS 시퀀싱을 위해 필요한 Flowcell입니다. 아이엠비디엑스는 일루미나코리아와의 협력관계를 통하여 가장 경쟁력 있는 수준으로 원재료를 공급받고 있습니다. 또한 비슷한 성능을 갖고 있는 타사의 제품을 지속적으로 테스트하여 다양한 원재료 구입처를 확보하고자 노력하고 있습니다. 표에서 보이는 미미한 가격변동은 아이엠비디엑스가 한 번에 구입하는 제품의 수량 및 재고 보유량에 따라서 발생하는 영업적 차원의 가격 변화이며, 환률 및 주변 환경 변화에 크게 변화가 없음을 확인할 수 있습니다. 아이엠비디엑스는 주 거래처와 지속적인 대화 및 영업매출 전략에 맞게 대량 구매를 통한 단가 하락을 목표로 지속적으로 노력하고 있습니다.
3) 주요 매입처

제작키트와 Flowcell 같은 원재료를 구성하는 품목들은 대부분 글로벌 외국계 회사가 제작하고 있지만, 모두 국내에 자사 및 직영 대리점을 운영하여 가격 및 재고 수급이 매우 안정적입니다. 또한, 소요가 많은 품목들은 국내 대리점을 배제하고 본사와 직접 거래하여 제품가격과 납품시간을 줄이는 방법을 모색하기 위하여 글로벌 회사와 협상중에 있습니다. 프로브(패널)를 제작하는 국내업체는 아이엠비디엑스와의 지속적인 커뮤니케이션을 통하여 아이엠비디엑스가 원하는 형태의 프로브(패널)를 맞춤 제작 방식으로 공급하고 있습니다. 아이엠비디엑스가 원하는 프로브(패널)를 제공할 수 있는 회사는 국내외에 여러 곳이 있으며, 필요시 해당 제품들을 사용하여 원재료 납품 가능하도록 관리하고 있습니다.
4) 생산능력 및 생산실적
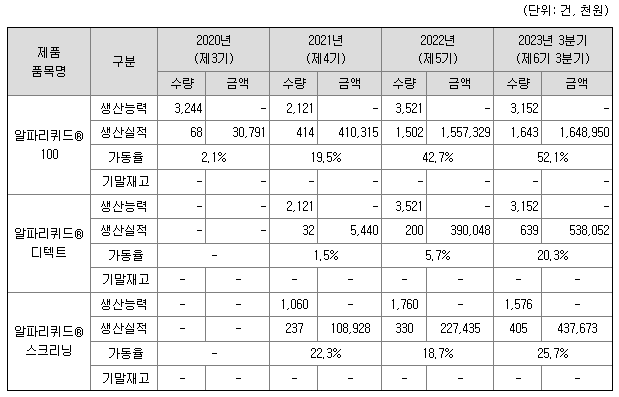
아이엠비디엑스의 제품 서비스 생산능력은 아이엠비디엑스가 보유하고 있는 NGS 분석 장치의 능력과 상관 관계가 있습니다. 아이엠비디엑스는 2018년 구입한 Nextseq550 system 장비를 통해 한주에 120Gb의 데이터 생성이 가능하며, 2020년 6월과 2022년 4월에 구입한 두대의 NovaSeq™ 6000 Sequencing System을 이용하여 한주에 추가적으로 6,000Gb의 데이터를 각각 생성할 수 있습니다. 총 3대의 장비를 사용하여 한주에 생성될 수 있는 데이터의 총량은 12,120Gb이며 연간 생산량은 630,240Gb입니다.
알파리퀴드®100와 알파리퀴드®디텍트를 서비스하기 위해서는 각각 50Gb의 사용이 필요하며, 알파리퀴드®스크리닝의 경우 100Gb의데이터 생성이 필요합니다. 2020년도에는 알파리퀴드®100 제품만을 생산 및 서비스하였으므로, Nextseq550 system와 NovaSeq™ 6000 Sequencing System을 이용하여 생성할 수 있는 모든 생산능력을 알파리퀴드®100 제품만을 위한 가동 능력으로 산정하였습니다. 2021년도 부터는 3개의 독립된 제품이 생산 공급된 관계로 Nextseq550 system와 NovaSeq™ 6000 Sequencing System을 이용하여 생성할 수 있는 전체 생산능력을 각각 3개의 제품으로 나누어 공급하는 것으로 산정하였습니다.
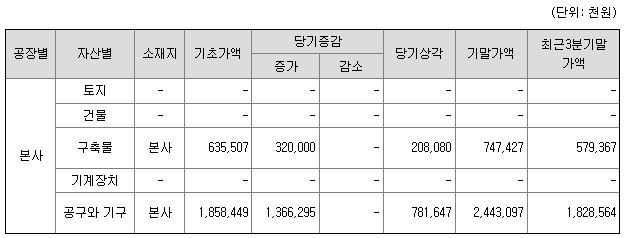
5) 생산설비
6) 생산설비의 신설 매입계획
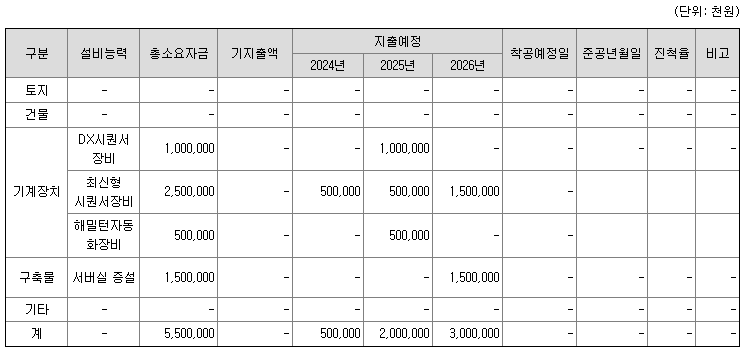
아이엠비디엑스 제품이 식약처 체외진단의료기기 품목허가를 받기 위해서 필요한 장비를 구입할 계획입니다. 체외진단의료기기는 질병의 검출, 진단, 예방, 모니터링, 치료, 완화를 위해 인체 외부에서 사용하는 의료기기를 말합니다. 이러한 체외진단의료기기 품목허가를 받기위해서는, 시퀀싱 기기도 진단용으로 등록된 Dx용 장비를 사용하여야 합니다. 해당 장비가 NovaSeq™ 6000Dx 시퀀싱 기기이며 아이엠비디엑스는 이를 위해 가급적 빠른 시일내에 해당 장비를 구매하여 임상적 성능시험 평가를 진행할 계획입니다.
IPO준비를 진행 중이거나 신규 상장한 기업을 이해하기 위한 목적이며, 투자 권유를 목적으로 하지 않습니다.
투자에 관한 결정은 투자자 본인에게 있으며 그 책임 또한 본인에게 있습니다.
'주식투자 > 2024년 IPO' 카테고리의 다른 글
| [2024년 신규상장 IPO] 민테크(Mintech Co., Ltd.) (7) | 2024.03.01 |
|---|---|
| [2024년 신규상장 IPO] 코칩(KORCHIP CORPORATION) (5) | 2024.02.16 |
| [2024년 신규상장 IPO] 삼현(SAMHYUN CO., Ltd. Co., Ltd.) (5) | 2024.02.14 |
| [2024년 신규상장 IPO] 엔젤로보틱스(ANGEL ROBOTICS Co., Ltd.) (7) | 2024.02.02 |
| [2024년 신규상장 IPO] 케이엔알시스템(KNR SYSTEMS INC.) (8) | 2024.01.30 |